Amoniak: Rozdiel medzi revíziami
d robot Pridal: is:Ammóníak |
d robot Pridal: nds:Ammoniak; cosmetic changes |
||
| Riadok 1: | Riadok 1: | ||
{{výstraha|riziko=T}}{{výstraha|riziko=N}} |
{{výstraha|riziko=T}}{{výstraha|riziko=N}} |
||
[[ |
[[Súbor:Ammonia-2D-dimensions.png|thumb|right|Štruktúrny vzorec]] |
||
'''Amoniak''' je binárna zlúčenina [[dusík]]a a [[vodík]]a so vzorcom NH<sub>3</sub>. Pri bežnom tlaku a teplote je to toxický, korozívny, bezfarebný [[plyn]] s charakteristickým prenikavým, ostrým, silne dráždivým zápachom. |
'''Amoniak''' je binárna zlúčenina [[dusík]]a a [[vodík]]a so vzorcom NH<sub>3</sub>. Pri bežnom tlaku a teplote je to toxický, korozívny, bezfarebný [[plyn]] s charakteristickým prenikavým, ostrým, silne dráždivým zápachom. |
||
| Riadok 25: | Riadok 25: | ||
{{Chemický výhonok}} |
{{Chemický výhonok}} |
||
| ⚫ | |||
[[Kategória:Hydridy]] |
[[Kategória:Hydridy]] |
||
[[Kategória:Zlúčeniny dusíka]] |
[[Kategória:Zlúčeniny dusíka]] |
||
[[Kategória:Emisie dopravných prostriedkov]] |
[[Kategória:Emisie dopravných prostriedkov]] |
||
| ⚫ | |||
[[ar:أمونياك]] |
[[ar:أمونياك]] |
||
| Riadok 69: | Riadok 68: | ||
[[ml:അമോണിയ]] |
[[ml:അമോണിയ]] |
||
[[ms:Ammonia]] |
[[ms:Ammonia]] |
||
[[nds:Ammoniak]] |
|||
[[nl:Ammoniak]] |
[[nl:Ammoniak]] |
||
[[nn:Ammoniakk]] |
[[nn:Ammoniakk]] |
||
Verzia z 10:04, 12. apríl 2009

|

|
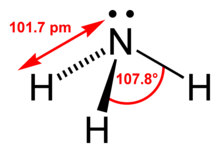
Amoniak je binárna zlúčenina dusíka a vodíka so vzorcom NH3. Pri bežnom tlaku a teplote je to toxický, korozívny, bezfarebný plyn s charakteristickým prenikavým, ostrým, silne dráždivým zápachom.
Molekula amoniaku je výrazne polárna a rozpúšťa sa vo vode, kde z disociovanej molekuly vody preberá protón za vzniku amónneho katiónu
- NH3 + H2O → NH4+ + OH−
Výsledný roztok je silne zásaditý a nazýva sa tiež "hydroxid amónny". Toto označenie je však len triviálne a nemá svoje opodstatnenie, lebo molekula "NH4OH" nejestvuje.
Neexistencia molekuly "NH4OH" je v súlade s faktom, že amoniak je Bronstedtova, a nie Arrheniova zásada. Zásaditý charakter amoniaku je totiž podmienený jeho schopnosťou viazať protón vodíka H+, a nie tvorbou hydroxidových iónov OH− v priebehu reakcie NH3 + H2O → NH4+ + OH− (podľa tejto reakcie reagujú len 4 z 1000 molekúl amoniaku). Správne označenie vodného roztoku amoniaku je teda NH3(aq).
V organickej chémii sa pre amoniak zaviedol systémový názov azán (a podobne pre jeho derivát hydrazín NH2-NH2 názov diazán).
Výroba
Až do začiatku 1. svetovej vojny sa amoniak vyrábal destiláciou rastlinného a živočíšneho materiálu, redukciou kyseliny dusitej a dusitanov vodíkom, alebo rozkladom amónnych solí hydroxidmi či priamo nehaseným vápnom (oxid vápenatý). Ako amónna soľ sa najčastejšie používal salmiak:
- 2 NH4Cl + 2 CaO → CaCl2 + Ca(OH)2 + 2 NH3
Začiatkom 1. svetovej vojny nemeckí chemici Fritz Haber a Carl Bosch navrhli postup, dnes zvaný Haber-Boschov proces na priamu syntézu amoniaku z plynného dusíka a vodíka:
- N2 + 3 H2 → 2 NH3
Iné projekty
 Commons ponúka multimediálne súbory na tému Amoniak
Commons ponúka multimediálne súbory na tému Amoniak
