Monoizotopický prvok
- Nezamieňať s heslom mononuklidický prvok.
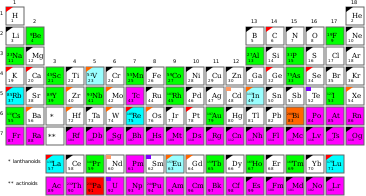
Monoizotopické prvky s prírodnými rádionuklidmi
Monoizotopický prvok je chemický prvok, ktorý má len jeden stabilný izotop (nuklid). Existuje len 26 prvkov, ktoré majú túto vlastnosť.
Stabilita prvkov je definovaná experimentálne, keďže existujú stabilné nuklidy s atómovým číslom vyšším než 40, ktoré sú teoreticky nestabilné, ale evidentne majú tak dlhé polčasy rozpadu, že ich rozpad nebol nikdy pozorovaný priamo ani nepriamo (meraním produktov ich rozkladu).
Monoizotopické prvky sú charakteristické (okrem jedného prípadu) nepárnym počtom protónov Z a párnym počtom neutrónov. Kvôli zisku energie na základe jadrových párovacích efektov spôsobuje nepárny počet protónov nestabilitu izotopov s nepárnym Z, čo u ťažších prvkov vyžaduje párový počet neutrónov, aby sa jadro stabilizovalo. Jediné prvky, ktoré majú stabilné nuklidy s nepárnym počtom protónov i neutrónov, sú 2H, 6Li, 10B, 14N a 180m1Ta.
Jediná výnimka tohto pravidla s nepárnym počtom protónov je berýlium. Jeho jediný stabilný prvotný izotop, 9Be, má 4 protóny a 5 neutrónov. Tento prvok nemá stabilný izotop so zhodným počtom protónov a neutrónov (8Be, 4 z každého) kvôli jeho tendencii rozkladu na alfa častice, ktoré sú výhodné kvôli extrémne silnej väzbe v jadre hélia (4He). Takisto však nemá stabilný izotop so 4 protónmi a 6 neutrónmi kvôli ich veľkému relatívnemu rozdielu pre tak ľahký prvok. Napriek tomu má 10Be polčas rozpadu asi 1,36 milióna rokov, čo je príliš málo na to, aby to bol prvotný nuklid, ale stále ukazuje nezvyčajnú stabilitu ľahkého prvku s tak veľkým relatívnym nepomerom častíc.
Rozdiel od mononuklidických prvkov[upraviť | upraviť zdroj]
Zoznam monoizotopických prvkov sa prekrýva, ale nie je zhodný, so zoznamom mononuklidických prvkov, ktoré sú charakterizované jediným izotopom (nuklidom) v prírode.[1] Dôvod pre tento rozdiel je prítomnosť niekoľkých rádioaktívnych prvotných nuklidov s dlhými polčasmi rozpadu v prírode, ktoré tvoria zmes s monoizotopickými prvkami, takže nie sú prirodzene mononuklidické. Táto situácia nastáva pre 7 monoizotopických prvkov: vanád, rubídium, indium, lantán, európium, rénium a lutécium. Pre dva z týchto prvkov (indium a rénium) je rádionuklid v skutočnosti bežnejší než stabilný izotop.
V dvoch ďalších prípadoch (bizmut[2] a protaktínium) existujú mononuklidické prvky, ktoré majú prvotné nuklidy (s dlhým polčasom rozpadu), ale nie sú monoizotopické, pretože tento nuklid je rádioaktívny, takže nemajú žiadne stabilné izotopy. Aby prvok mohol byť monoizotopický, musí mať jeden stabilný nuklid.
Zoznam monoizotopických prvkov[upraviť | upraviť zdroj]
Prvky, ktoré nie sú mononuklidické, sú označené hviezdičkou a je u nich uvedený rádioizotop s dlhým polčasom rozpadu. V dvoch prípadoch (indium a rénium) je rádioizotop bežnejší než stabilný izotop a v jednom prípade (európium) sa vyskytujú približne rovnako často.
- Berýlium-9
- Fluór-19
- Sodík-23
- Hliník-27
- Fosfor-31
- Skandium-45
- Vanád-51*, v prírode existuje 0,25 % rádioaktívneho izotopu vanád-50
- Mangán-55
- Kobalt-59
- Arzén-75
- Rubídium-85*, v prírode existuje 27,84 % rádioaktívneho izotopu rubídium-87
- Ytrium-89
- Niób-93
- Ródium-103
- Indium-113*, v prírode existuje 0,09 % rádioaktívneho izotopu indium-115
- Jód-127
- Cézium-133
- Lantán-139*, v prírode existuje 95,7 % rádioaktívneho izotopu lantán-138
- Prazeodým-141
- Európium-153*, v prírode existuje 47,8 % rádioaktívneho izotopu lantán-138
- Terbium-159
- Holmium-165
- Túlium-169
- Lutécium-175*, v prírode existuje 2,59 % rádioaktívneho izotopu lutécium-176
- Rénium-185*, v prírode existuje 62,6 % rádioaktívneho izotopu rénium-187
- Zlato-197
Referencie[upraviť | upraviť zdroj]
- ↑ N. E. Holden, "Standard Atomic Weight Values for the Mononuclidic Elements - 2001," BNL-NCS-68362, Brookhaven National Laboratory (2001)
- ↑ Až do roku 2003 sa predpokladalo, že 209Bi patrí do prvej kategórie. Potom sa zistilo, že jeho polčas rozpadu je 1019 rokov, teda asi 109x vek vesmíru.
