S-adenozylmetionín
| S-Adenozylmetionín | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C15H22N6O5S |
| Synonymá | S-Adenozyl-L-metionín, SAM-e, SAMe, AdoMet, Heparab (India), ademetionín |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 398,44 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 29908-03-0 485-80-3 (protónovaná aminoskupina metionínu) |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
S-sdenozylmetionín[1] (alebo SAM, SAM-e či AdoMet)[2] je kofaktor pre mnohé enzýmy. Je to bežný substrát pre metylačné reakcie (prenos metylovej skupiny), transsulfurácie a aminopropylácie. Aj keď tieto anabolické reakcie prebiehajú všade v tele, SAM sa v najväčšej miere vytvára a spotrebováva v pečeni.[3] Je známych viac ako 40 reakcií, pri ktorých sa prenáša metylová skupina zo SAM na rôzne substráty, napríklad nukleové kyseliny, bielkoviny, lipidy a sekundárne metabolity. SAM vzniká z adenozíntrifosfátu (ATP) a metionínu pôsobením metionínadenozyltransferázy. SAM bol prvýkrát objavený Giuliom Cantonim v roku 1952.[3]
U baktérií sa SAM viaže na SAM riboswitch, ktorý reguluje gény, ktoré sa účastnia biosyntézy metionínu alebo cysteínu (sírnych aminokyselín). V eukaryotických bunkách pôsobí SAM ako regulátor rôznych procesov, vrátane metylácie DNA, tRNA a rRNA, imunitnej odpovede,[4] metabolizmu aminokyselín, transsulfurácií a mnohých ďalších. U rastlín je SAM veľmi dôležitý v biosyntéze etylénu, čo je dôležitý rastlinný hormón a signálna molekula.[5]
Štruktúra[upraviť | upraviť zdroj]

S-sdenozylmetionín pozostáva z adenozylového katiónu naviazaného na sírový atóm metionínu.Vzniká z ATP a metionínu pôsobením S-adenozylmetionínsyntetázy, ktorá pôsobí nasledujúcu reakciu:
- ATP + L-metionín + H2O ↔ S-adenozylmetionín + fosfát + pyrofosfát
Sulfóniová funkčná skupina prítomná v SAM je zdrojom jeho zvláštnej reaktivity. V závislosti na enzýme je možné SAM premeniť na jeden z troch produktov:
- deoxyadenozylový radikál, popri ktorom vzniká i metionín; klasická radikálová SAM reakcia, radikál sa viaže naspäť a obnovuje SAM[6] alebo sa premieňa na deoxyadenozín
- S-adenozylhomocysteín, popri ktorom vzniká i metylový radikál
- metyltioadenozín, popri ktorom vzniká homoalanínový radikál
Biochémia[upraviť | upraviť zdroj]
SAM cyklus[upraviť | upraviť zdroj]
Reakcie, ktoré tvoria, spotrebovávajú a obnovujú SAM, sa nazývajú SAM cyklus.
V prvom kroku tohto cyklu sa SAM využíva ako substrát pre SAM-dependentné metylázy (EC 2.1.1), ktoré tvoria S-adenozylhomocysteín.[7] S-adenozylhomocysteín je silný negatívny regulátor takmer všetkých SAM-dependentných metyláz napriek ich biologickej diverzite. S-adenozylhomocysteín sa hydrolyzuje na homocysteín a adenozín pôsobením S-adenozylhomocysteínhydrolázy (EC 3.3.1.1) a vzniknutý homocysteín sa recykluje naspäť na metionín pomocou prenosu metylovej skupiny z 5-metyltetrahydrofolátu. Túto reakciu katalyzujú dve rodiny enzýmov metionínsyntáz (kobalamín-dependentné (EC 2.1.1.13) alebo kobalamín-independentné (EC 2.1.1.14)). Metionín sa potom môže premeniť znovu na SAM v reakcii katalyzovanej metionínadenozyltransferázou, čím sa dokončuje cyklus.[8]
Rýchlosť určujúcim krokom tohto cyklu je reakcia katalyzovaná MTHFR (metyléntetrahydrofolátreduktázou), ktorá ireverzibilne redukuje 5,10-metyléntetrahydrofolát na 5-metyltetrahydrofolát.[9]

Radikálové SAM enzýmy[upraviť | upraviť zdroj]

Mnohé enzýmy štiepia SAM tak, aby z neho vznikali radikály: 5'-deoxyadenozylový 5'-radikál, metylový radikál, a iné. Tieto enzýmy sa nazývajú radikálové SAM enzýmy. Všetky obsahujú vo svojom aktívnom mieste železosírny klaster.[10] Väčšina enzýmov s touto schopnosťou zdieľa sekvenčnú homológiu, ktorá spočíva v motíve CxxxCxxC alebo podobnom variante. Táto sekvencia umožňuje trom cysteínovým reziduám viazať tri zo štyroch kovov v 4Fe-4S klastri. Posledný, štvrtý atóm železa viaže priamo SAM.
Radikálové intermediáty, ktoré tieto enzýmy tvoria, potom vykonávajú rôznorodé nezvyčajné chemické reakcie. Príkladmi radikálových SAM enzýmov sú aktivázy pyruvátformiátlyázy a anaeróbnych sulfatáz, lyzín-2,3-aminomutáza a rôzne enzýmy v biosyntéze kofaktorov, úprave peptidov, tvorbe klastrov metaloproteínov, modifikácii tRNA, lipidového metabolizmu a iných. Niektoré radikálové SAM enzýmy používajú druhú molekulu SAM ako donor metylovej skupiny. Radikálové SAM enzýmy sú omnoho bežnejšie u anaeróbnych baktérií než u aeróbnych organizmov. Nachádzajú sa vo všetkých doménach života a nie sú poriadne preskúmané. Nedávna bioinformatická štúdia došla k záveru, že táto rodina enzýmov obsahuje aspoň 114 000 sekvencií a 65 unikátnych reakcií.[11]
Biosyntéza polyamínov, hormónov[upraviť | upraviť zdroj]
Ďalšia dôležitá úloha SAM je v biosyntéze polyamínov. V týchto procesoch sa SAM dekarboxyluje pôsobením adnozylmetioníndekarboxylázy (EC 4.1.1.50), čím vzniká S-adenozylmetionínamín. Táto zlúčenina potom štiepi svoju n-propylamínovú skupinu, ktorá sa využíva v biosyntéze polyamínov ako sú spermidín, spermín a putrescín.[12]
SAM je vyžadovaný pre rast a opravu buniek. Takisto sa účastní biosyntézy nikoľkých hormónov a neurotransmiterov, ktoré ovplyvňujú náladu, napríklad epinefrínu. Metyltransferázy sú zodpovedné za adíciu metylovej skupiny na 2' hydroxylovú skupinu prvého a druhého nukleotidu vedľa 5' čiapočky na mRNA.[13][14]
Ostatné reakcie[upraviť | upraviť zdroj]
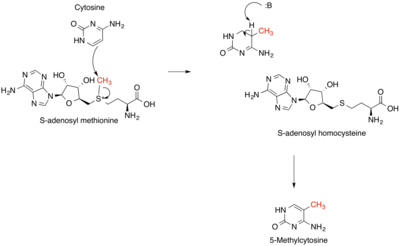
SAM vystupuje i v mnohých iných reakciách, typicky v metylačných reakciách. Účastní sa napríklad metylácie cytozínu v DNA, čo je dôležitý epigenetický riadiaci faktor. Okrem toho sa radikálové SAM enzýmy účastnia napríklad biosyntézy vitamínov tiamínu a kobalamínu (oba z 5-aminoimidazolribotidu).[15]
Terapeutické použitie[upraviť | upraviť zdroj]
V roku 2012 neexistoval definívny záver, či SAM utlmuje bolesť z osteoartritídy. Klinické skúšky, ktoré prebehli, boli príliš malé na to, aby ich bolo možné zovšeobecniť.[16]
SAM cyklus bol veľmi úzko spájaný s pečeňou už od roku 1947, pretože ľudia s alkoholickou cirhózou pečene mali zvýšené hladiny metionínu v krvi.[17] Aj keď existovalo niekoľko dôkazov (laboratórnych testov na bunkách a zvieracích modeloch), podľa ktorých by SAM mohol pomôcť s liečením rôznych poškodení pečene, v roku 2012 nebol SAM študovaný v väčšej randomizovanej placebom kontrolovanej klinickej skúške, ktorá by umožnila posúdenie jeho pôsobivosti alebo nezávadnosti.[18][19]
Farmakokinetika[upraviť | upraviť zdroj]
Orálne podaný SAM dosahuje najvyššiu hladinu koncentrácie v plazme tri až päť hodín po požití potiahnutej tabletky (400-1000 mg). Polčas života je asi 100 minút.[20]
Depresia[upraviť | upraviť zdroj]
V roku 2016 jedna review zhodnotila, že neexistujú dostatočne kvalitné dôkazy pre použitie SAM na liečbu depresie, aby sa z nich dal urobiť záver, a že jeho využitie v liečbe depresie by malo byť ďalej skúmané.[21]
Systematická review v roku 2020 ukázala, že SAM pomáha výrazne lepšie než placebo a má podobné výsledky ako iné bežne používané antidepresíva (imipramín alebo escitalopram).[22]
Jedna štúdia z roku 2004 ukázala, že SAM výrazne zlepšuje depresiu u HIV-pozitívnych pacientov. Štúdia však testovala len na 20 osobách a bez kontrolnej skupiny s placebom, takže môžu byť nutné ďalšie výsledky na lepšie posúdenie.[23]
Nežiaduce účinky[upraviť | upraviť zdroj]
Pri používaní SAM môžu nastať gastrointestinálne poruchy, dyspepsia a úzkosť.[20] Dlhodobé účinky SAM nie sú známe. SAM je slabé DNA-alkylačné činidlo.[24]
Ďalším nahláseným vedľajším účinkom SAM je nespavosť, takže je väčšinou odporúčená požívať ho ráno. Ďalšie nahlásené mierne vedľajšie účinky zahŕňajú nechuť do jedla, zápchy, závrate, sucho v ústach, potenie a úzkosť/nervozitu, ale v štúdiách kontrolovaných placebom sa tieto vedľajšie účinky objavujú približne tak často, ako v skupinách, ktorým je podávané placebo.[chýba zdroj]
Nedávno bolo ukázané, že SAM má svoj význam i v epigenetickej regulácii. Metylácia DNA je kľúčový regulátor epigenetických modifikácií počas vývoja a diferenciácie cicavčích buniek. U myší bola zvýšená hladina SAM spojená s nesprávnou metyláciou asociovanou s diabetickou neuropatiou. SAM pôsobí ako donor metylovej skupiny v metylácii cytozínu, čo je kľúčový epigenetický regulačný proces.[25] Kvôli dopadu tejto epigenetickej regulácie bol SAM testovaný pre použitie proti rakovine. Proliferácia (delenie) rakovinových buniek je závislé na nízkych hladinách metylácie DNA. Bolo preukázané, že prídavok SAM in vitro remetyluje promotórové sekvencie a znižuje tvorbu proto-onkogénov.[26]
Nedostatočná aktivita radikálových SAM enzýmov bola spojená s rôznymi poruchami, vrátane vrodenej srdcovej poruchy, amyotrofickej laterálnej sklerózy a zvýšenou náchylnosťou na vírusy.[11]
Štúdia z roku 2022 usúdila, že SAM môže byť toxický. Jean-Michel Fustin z Manchesterskej univerzity tvrdí, že výskumnici zistili, že SAM sa v tele rozkladá na roxické látky adenín a metyltioadenozín. Toto bolo pozorované v laboratórnych myšiach, čo viedlo k zhoršeniu zdravia, a in vitro v testoch na ľudských bunkách.[27][28]
Interakcie a kontraindikácie[upraviť | upraviť zdroj]
Požívaním SAM naraz s inými liečivami môže zvýšiť riziko serotonínového syndrómu, čo je potenciálne nebezpečný stav spôsobený nadbytkom serotonínu. Medzi tieto liečivá patrí dextrometorfán (Robitussin), meperidín, pentazocín a tramadol.[chýba zdroj]
SAM môže takisto interagovať s antidepresívami — vrátane tryptofánu a Hypericum perforatum (ľubovníkom bodkovaným) — čo zvyšuje riziko vzniku serotonínového syndrómu alebo iných vedľajších účinkov a môže znížiť efektivitu levodopa pre liečbu Parkinsonovej choroby.[29]
Ľudia s bipolárnou poruchou by nemali užívať SAM, pretože zvyšuje riziko manických epizód.[29]
Dostupnosť v rôznych krajinách[upraviť | upraviť zdroj]
V Kanade, Spojenom kráľovstve[28] a Spojených štátoch sa SAM predáva ako potravinový doplnok pod názvom SAM-E (prípadne SAME alebo SAMe).[30] Prvýkrát sa začal predávať v roku 1999.[31]
SAM je liečivo na predpis v Taliansku od roku 1979, v Španielsku od roku 1985 a v Nemecku od roku 1989.[31] Od roku 2012 sa predáva ako liek na predpis v Rusku, Indii, Číne, Taliansku, Nemecku, Vietname a Mexiku.[19]
Referencie[upraviť | upraviť zdroj]
- ↑ ŠKÁRKA, Bohumil; FERENČÍK, Miroslav. Biochémia. 3. vyd. [s.l.] : [s.n.], 1992. ISBN 80-05-01076-1. S. 251, 285.
- ↑ PUBCHEM. AdoMet [online]. pubchem.ncbi.nlm.nih.gov, [cit. 2022-07-30]. Dostupné online. (po anglicky)
- ↑ a b CANTONI, GL. The Nature of the Active Methyl Donor Formed Enzymatically from L-Methionine and Adenosinetriphosphate. J Am Chem Soc, 1952, s. 2942–3. DOI: 10.1021/ja01131a519.
- ↑ S-Adenosylmethionine Levels Govern Innate Immunity through Distinct Methylation-Dependent Pathways. Cell Metabolism, 2015-10-06, s. 633–645. DOI: 10.1016/j.cmet.2015.07.013. PMID 26321661.
- ↑ Characterization of S-adenosylmethionine synthetases in soybean under flooding and drought stresses. Biologia Plantarum, 2016-06-01, s. 269–278. ISSN 0006-3134. DOI: 10.1007/s10535-016-0586-6. (po anglicky)
- ↑ HORITANI, Masaki; BYER, Amanda S.; SHISLER, Krista A.. Why Nature Uses Radical SAM Enzymes so Widely: Electron Nuclear Double Resonance Studies of Lysine 2,3-Aminomutase Show the 5′-dAdo• “Free Radical” Is Never Free. Journal of the American Chemical Society, 2015-06-10, roč. 137, čís. 22, s. 7111–7121. Dostupné online [cit. 2022-07-30]. ISSN 0002-7863. DOI: 10.1021/jacs.5b00498. (po anglicky)
- ↑ Homocysteine. The International Journal of Biochemistry & Cell Biology, 2000, s. 385–9. DOI: 10.1016/S1357-2725(99)00138-7. PMID 10762063.
- ↑ Molecular biology of 5,10-methylenetetrahydrofolate reductase. J Nephrol, Jan—Feb 2000, s. 20–33. PMID 10720211.
- ↑ Human methylenetetrahydrofolate reductase: isolation of cDNA, mapping and mutation identification. Nature Genetics, 1994-06-01, s. 195–200. ISSN 1061-4036. DOI: 10.1038/ng0694-195. PMID 7920641.
- ↑ Mechanistic and functional versatility of radical SAM enzymes. F1000 Biology Reports, 2010, s. 52. DOI: 10.3410/B2-52. PMID 21152342.
- ↑ a b Radical S-Adenosylmethionine Enzymes in Human Health and Disease. Annual Review of Biochemistry, 2016-06-13, s. 485–514. DOI: 10.1146/annurev-biochem-060713-035504. PMID 27145839. (po anglicky)
- ↑ Roje S. S-Adenosyl-L-methionine: beyond the universal methyl group donor. Phytochemistry, 2006, s. 1686–98. DOI: 10.1016/j.phytochem.2006.04.019. PMID 16766004.
- ↑ Loenen W. S-Adenosylmethionine: jack of all trades and master of everything?. Biochem Soc Trans, 2006, s. 330–3. DOI: 10.1042/BST20060330. PMID 16545107.
- ↑ S-Adenosylmethionine and methylation. FASEB J, 1996, s. 471–80. DOI: 10.1096/fasebj.10.4.8647346. PMID 8647346.
- ↑ MEHTA, Angad P.; ABDELWAHED, Sameh H.; FENWICK, Michael K.. Anaerobic 5-Hydroxybenzimidazole Formation from Aminoimidazole Ribotide: An Unanticipated Intersection of Thiamin and Vitamin B 12 Biosynthesis. Journal of the American Chemical Society, 2015-08-26, roč. 137, čís. 33, s. 10444–10447. Dostupné online [cit. 2022-07-30]. ISSN 0002-7863. DOI: 10.1021/jacs.5b03576. (po anglicky)
- ↑ S-Adenosylmethionine for osteoarthritis of the knee or hip.. The Cochrane Database of Systematic Reviews, 7 October 2009, s. CD007321. Dostupné online. DOI: 10.1002/14651858.CD007321.pub2. PMID 19821403.
- ↑ MATO, Jose M. S-adenosylmethionine synthesis: Molecular mechanisms and clinical implications. Pharmacology & Therapeutics, 1997, s. 265–280. DOI: 10.1016/s0163-7258(96)00197-0. PMID 9175157.
- ↑ S-Adenosylmethionine (SAMe) therapy in liver disease: a review of current evidence and clinical utility. Journal of Hepatology, November 2012, s. 1097–109. Dostupné online. DOI: 10.1016/j.jhep.2012.04.041. PMID 22659519.
- ↑ a b S-Adenosylmethionine in liver health, injury, and cancer. Physiological Reviews, October 2012, s. 1515–42. DOI: 10.1152/physrev.00047.2011. PMID 23073625.
- ↑ a b S-Adenosyl methionine (SAMe) versus celecoxib for the treatment of osteoarthritis symptoms: A double-blind cross-over trial. ISRCTN36233495. BMC Musculoskelet Disord, February 2004, s. 6. DOI: 10.1186/1471-2474-5-6. PMID 15102339.
- ↑ S-Adenosyl methionine (SAMe) for depression in adults.. The Cochrane Database of Systematic Reviews, 10 October 2016, s. CD011286. DOI: 10.1002/14651858.CD011286.pub2. PMID 27727432.
- ↑ S-Adenosylmethionine (SAMe) in major depressive disorder (MDD): a clinician-oriented systematic review. Annals of General Psychiatry (Springer Science and Business Media LLC), 2020-09-05, s. 50. ISSN 1744-859X. DOI: 10.1186/s12991-020-00298-z. PMID 32939220.
- ↑ SHIPPY, R. Andrew; MENDEZ, Douglas; JONES, Kristina. S-adenosylmethionine (SAM-e) for the treatment of depression in people living with HIV/AIDS. BMC Psychiatry, 2004-11-11, roč. 4, čís. 1, s. 38. Dostupné online [cit. 2022-07-30]. ISSN 1471-244X. DOI: 10.1186/1471-244X-4-38.
- ↑ Nonenzymatic methylation of DNA by the intracellular methyl group donor S-adenosyl-L-methionine is a potentially mutagenic reaction. EMBO J., 1982, s. 211–6. DOI: 10.1002/j.1460-2075.1982.tb01149.x. PMID 7188181.
- ↑ VARELA-REY, Marta. S-Adenosylmethionine Levels Regulate the Schwann Cell DNA Methylome. Neuron, 2014, s. 1024–1039. DOI: 10.1016/j.neuron.2014.01.037. PMID 24607226.
- ↑ Treatment of prostate cancer cells with S-adenosylmethionine leads to genome-wide alterations in transcription profiles. Gene, 2016-12-31, s. 161–167. DOI: 10.1016/j.gene.2016.09.032. PMID 27688072.
- ↑ FUKUMOTO, Kazuki; ITO, Kakeru; SAER, Benjamin. Excess S-adenosylmethionine inhibits methylation via catabolism to adenine. Communications Biology (Nature Publishing Group), 5 April 2022. ISSN 2399-3642. DOI: 10.1038/s42003-022-03280-5. PMID 35383287.
- ↑ a b MCKIE, Robin. Biologists warn against toxic SAMe 'health' supplement. The Observer, 10 April 2022. Dostupné online.
- ↑ a b S-Adenosyl-L-Methionine (SAMe): In Depth [online]. National Center for Complementary and Integrative Health (NCCIH), January 11, 2017. Dostupné online. (po anglicky)
- ↑ WOOLSTON, Chris. What is SAM-e? [online]. 31 December 2020, [cit. 2022-07-30]. Dostupné online. Archivované 2022-12-07 z originálu.
- ↑ a b S-Adenosyl-L-methionine (SAMe): from the bench to the bedside--molecular basis of a pleiotrophic molecule. The American Journal of Clinical Nutrition, November 2002, s. 1151S–1157S. DOI: 10.1093/ajcn/76.5.1151S. PMID 12418493.
Pozri aj[upraviť | upraviť zdroj]
- DNA metyltransferáza
- SAM-I riboswitch
- SAM-II riboswitch
- SAM-III riboswitch
- SAM-IV riboswitch
- SAM-V riboswitch
- SAM-VI riboswitch
Zdroj[upraviť | upraviť zdroj]
Tento článok je čiastočný alebo úplný preklad článku S-Adenosyl methionine na anglickej Wikipédii.
