Kyselina peroxodisírová: Rozdiel medzi revíziami
Vytvorené prekladom stránky „Kyselina peroxodisírová“ Značky: sekcia Referencie umiestnenie šablóny Preklad preklad obsahu Překlad 2 |
Menšie opravy |
||
| Riadok 1: | Riadok 1: | ||
{{Infobox Chemická zlúčenina |
|||
{{Pracuje sa}}{{Infobox Chemická zlúčenina|Názov=Kyselina peroxodisírová|Obrázok=Peroxodischwefelsäure.svg|Obrázok2=Peroxydisulfuric-acid-3D-balls.png|Vzorec=H2S2O8, (S02OH)2OO|Synonymá=Kyselina perdisírová, Kyselina peroxydisírová, Sulfooxyhydrogénsulfát (IUPAC)|Vzhľad=Nestabilná bezfarebná kryštalická látka|Molekulová hmotnosť=194,1 u|Molárna hmotnosť=194.1411 g/mol|Teplota rozkladu=65 °C|Hustota=2,5 ± 0,1 g/cm3|CAS=13445-49-3}} |
|||
| Názov = Kyselina peroxodisírová |
|||
| Obrázok = Peroxodischwefelsäure.svg |
|||
| Obrázok2 = Peroxydisulfuric-acid-3D-balls.png |
|||
| Vzorec = H<sub>2</sub>S<sub>2</sub>O<sub>8</sub><br>(S0<sub>2</sub>OH)<sub>2</sub>OO |
|||
| Synonymá = Sulfooxyhydrogénsulfát (''IUPAC'')<br>Kyselina perdisírová<br>Kyselina peroxydisírová<br>Marshallová kyselina |
|||
| Vzhľad = Nestabilná bezfarebná kryštalická látka |
|||
| Molekulová hmotnosť = 194,1 u |
|||
| Molárna hmotnosť = {{gmol|194.1411|m|w}} |
|||
| Teplota topenia = |
|||
| Teplota varu = |
|||
| Teplota sublimácie = |
|||
| Teplota rozkladu = 65 °C |
|||
| Trojný bod = |
|||
| Kritický bod = |
|||
| Kritická teplota = |
|||
| Kritický tlak = |
|||
| Kritická hustota = |
|||
| Hustota = {{gcm3|2.5 ± 0.1|m|w}} |
|||
| Rozpustnosť = |
|||
| Skupenské teplo topenia = |
|||
| Entropia topenia = |
|||
| Entropia varu = |
|||
| Entropia rozpúšťania = |
|||
| Entropia sublimácie = |
|||
| Skupenské teplo vyparovania = |
|||
| Štandardná zlučovacia entalpia = |
|||
| Štandardná entropia = |
|||
| Štandardná Gibbsová energia = |
|||
| Merná tepelná kapacita = |
|||
| Teplota vzplanutia = |
|||
| Teplota vznietenia = |
|||
| Medze výbušnosti = |
|||
| externé dáta MSDS = |
|||
| GHS zdroj = |
|||
| GHS piktogram = {{GHS|}} |
|||
| heslo GHS = |
|||
| vety H = {{vety H|}} |
|||
| vety EUH = {{vety EUH|}} |
|||
| vety P = {{vety P|}} |
|||
| EÚ zdroj = |
|||
| EÚ piktogram = {{Výstraha|O}} |
|||
| vety R = {{vety R|-}} |
|||
| vety S = {{vety S|-}} |
|||
| NFPA 704 = <!-- {{NFPA 704|Horľavosť = |Zdravie = |Reaktivita = |Ostatné = }} --> |
|||
| NFPA 704 zdroj = |
|||
| CAS = 13445-49-3 |
|||
| UN = |
|||
| EC číslo (EINECS/ELINCS/NLP) = |
|||
| Číslo RTECS = |
|||
| ulr = |
|||
}} |
|||
'''Kyselina peroxodisírová''' H<sub>2</sub>S<sub>2</sub>O<sub>8</sub>, tiež sa nazýva '''Marshallová kyselina''' po profesorovi [[Hugh Marshall|Hughovi Marshallovi]], ktorý ju ako prvý vytvoril |
'''Kyselina peroxodisírová''' H<sub>2</sub>S<sub>2</sub>O<sub>8</sub>, tiež sa nazýva '''Marshallová kyselina''' po profesorovi [[Hugh Marshall|Hughovi Marshallovi]], ktorý ju ako prvý vytvoril, je z jednou [[Peroxokyselina|peroxokyselín]] [[Síra|síry]]. [[Anión]] vznikajúci nahradením dvoch atómov [[Vodík|vodíka]] sa nazýva ''peroxodisíranový'' (zastaralo ''persíranový anión).'' Soli odvodené od kyseliny peroxodisírové sa nazývajú [[peroxosírany|peroxodisírany]] a [[hydrogenperoxodisírany]] . |
||
== Vlastnosti == |
== Vlastnosti == |
||
| Riadok 7: | Riadok 58: | ||
== Syntéza == |
== Syntéza == |
||
Kyselina peroxodisírová sa pripravuje reakciou [[Kyselina chlórsírová|kyseliny chlórsírovej]] s [[Peroxid vodíka|peroxidom vodíka]]:<ref>{{Citácia |
Kyselina peroxodisírová sa pripravuje reakciou [[Kyselina chlórsírová|kyseliny chlórsírovej]] s [[Peroxid vodíka|peroxidom vodíka]]:<ref>{{Citácia elektronického dokumentu|priezvisko=Jakob|meno=Harald|titul="Peroxo Compounds, Inorganic"|periodikum=Ullmann's Encyclopedia of Industrial Chemistry|vydavateľ=Wiley-VCH|miesto=Weinheim|dátum=2007-07-15|dátum prístupu=2021-03-19|priezvisko2=Leininger|meno2=Stefan|priezvisko3=Lehmann|meno3=Thomas|spoluautori=et al.|doi=10.1002/14356007.a19_177.pub2|jazyk=po anglicky}}</ref> |
||
2ClSO<sub>3</sub>H + H<sub>2</sub>O<sub>2</sub> → H<sub>2</sub>S<sub>2</sub>O<sub>8</sub> + 2 HCl |
: 2ClSO<sub>3</sub>H + H<sub>2</sub>O<sub>2</sub> → H<sub>2</sub>S<sub>2</sub>O<sub>8</sub> + 2 HCl |
||
| ⚫ | |||
: |
|||
| ⚫ | |||
: H<sub>2</sub>SO<sub>4</sub> + H<sub>2</sub>O → H<sub>3</sub>O<sup>+</sup> + HSO<sub>4</sub><sup>−</sup> (disociácia kyseliny sírovej) |
|||
: 2HSO<sub>4</sub><sup>−</sup> → H<sub>2</sub>S<sub>2</sub>O<sub>8</sub> + 2e<sup>−</sup> (E<sub>0</sub> = +2.4V) (oxidácia hydrogénsíranu) |
|||
: 2H<sub>2</sub>SO<sub>4</sub> → H<sub>2</sub>S<sub>2</sub>O<sub>8</sub> + H<sub>2</sub> (celková reakcia) |
|||
: 3H<sub>2</sub>O → O<sub>3</sub> + 6H<sup>+</sup> (ozón ako vedľajší produkt) |
|||
== Použitie == |
== Použitie == |
||
| Riadok 22: | Riadok 73: | ||
Literatúra |
== Literatúra == |
||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
| ⚫ | |||
{{Referencie}} |
{{Referencie}} |
||
| ⚫ | |||
| ⚫ | |||
{{Projekt}} |
|||
{{Projekt|commons=Category:Peroxydisulfuric acid}} |
|||
| ⚫ | |||
| ⚫ | |||
{{Kyseliny VI.}} |
|||
| ⚫ | |||
[[Kategória:Anorganické kyseliny|Peroxodisírová]] |
|||
| ⚫ | |||
[[Kategória: |
[[Kategória:Kyseliny síry|Peroxodisírová]] |
||
[[Kategória:Kyseliny síry]] |
|||
[[Kategória:Peroxokyseliny]] |
[[Kategória:Peroxokyseliny]] |
||
[[Kategória:Peroxodisírany]] |
[[Kategória:Peroxodisírany]] |
||
Verzia z 18:20, 19. marec 2021
| Kyselina peroxodisírová | |||||||||||||||||||
 | |||||||||||||||||||
 | |||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||
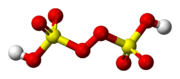
| Sumárny vzorec | H2S2O8 (S02OH)2OO | ||||||||||||||||||
| Synonymá | Sulfooxyhydrogénsulfát (IUPAC) Kyselina perdisírová Kyselina peroxydisírová Marshallová kyselina | ||||||||||||||||||
| Vzhľad | Nestabilná bezfarebná kryštalická látka | ||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||
| Molekulová hmotnosť | 194,1 u | ||||||||||||||||||
| Molárna hmotnosť | 194,1411 g/mol | ||||||||||||||||||
| Teplota rozkladu | 65 °C | ||||||||||||||||||
| Hustota | 2,5 ± 0,1 g/cm3 | ||||||||||||||||||
| |||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||
| Číslo CAS | 13445-49-3 | ||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||
Kyselina peroxodisírová H2S2O8, tiež sa nazýva Marshallová kyselina po profesorovi Hughovi Marshallovi, ktorý ju ako prvý vytvoril, je z jednou peroxokyselín síry. Anión vznikajúci nahradením dvoch atómov vodíka sa nazýva peroxodisíranový (zastaralo persíranový anión). Soli odvodené od kyseliny peroxodisírové sa nazývajú peroxodisírany a hydrogenperoxodisírany .
Vlastnosti
Kyselina peroxodisírová je nestabilná bezfarebná kryštalická látka so silnými oxidačnými účinkami. Reaguje až výbušne s organickými látkami.
Syntéza
Kyselina peroxodisírová sa pripravuje reakciou kyseliny chlórsírovej s peroxidom vodíka:[1]
- 2ClSO3H + H2O2 → H2S2O8 + 2 HCl
Ďalšou metódou je elektrolýza mierne koncentrovanej kyseliny sírovej (60 - 70%) s platinovými elektródami pri vysokej prúdovej hustote a napätí:
- H2SO4 + H2O → H3O+ + HSO4− (disociácia kyseliny sírovej)
- 2HSO4− → H2S2O8 + 2e− (E0 = +2.4V) (oxidácia hydrogénsíranu)
- 2H2SO4 → H2S2O8 + H2 (celková reakcia)
- 3H2O → O3 + 6H+ (ozón ako vedľajší produkt)
Použitie
Kyselina peroxodisírová sa používa na výrobu farbív a peroxidu vodíka. Využíva sa aj v analytickej chémii.
Literatúra
GREENWOOD, Norman Neill; EARNSHAW, Alan. Chemie prvků. 1. vyd. Praha : Informatorium, 1993. ISBN 80-85427-38-9. (po česky)
Referencie
- ↑ JAKOB, Harald; LEININGER, Stefan; LEHMANN, Thomas, et al. "Peroxo Compounds, Inorganic". Weinheim: Wiley-VCH, 2007-07-15, [cit. 2021-03-19]. DOI:10.1002/14356007.a19_177.pub2 (po anglicky)
Iný projekt
 Commons ponúka multimediálne súbory na tému Kyselina peroxodisírová
Commons ponúka multimediálne súbory na tému Kyselina peroxodisírová
Zdroj
Tento článok je čiastočný alebo úplný preklad článkov Kyselina peroxodisírová na českej Wikipédii a Peroxydisulfuric acid na anglickej Wikipédii.

