Izoelektronicita
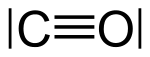 
|
| Oxid uhoľnatý a nitrozónium sú izoelektronické. |
Izoelektronicita je fenomén pozorovaný u dvoch alebo viacerých molekúl, ktoré majú rovnakú štruktúru (pozície atómov a väzby medzi nimi) a rovnakú elektrónovú konfiguráciu, ale líšia sa vzájomnou polohou prvkov v danej štruktúre. Štruktúry, ktoré spĺňajú tento popis, sú navzájom izoelektronické.
Napríklad CO, NO+ a N2 sú izoelektronické, ale CH3COCH3 a CH3N=NCH3 nie sú.[1]
Táto definícia sa občas nazýva valenčná izoelektronicita. Niekedy sú definíce striktnejšie a vyžadujú zhodný celkový počet elektrónov a s ním celkovú elektronickú konfiguráciu.[2] Častejšie sú však definície menej striktné a povoľujú i rôzne počty atómov v jednotlivých porovnávaných látkach.[3]
Dôležitosť tohto konceptu spočíva v identifikácii významne príbuzných látok, napríklad párov alebo skupín. Očakáva sa, že izoelektronické látky budú vykazovať užitočnú konzistenciu a predikovateľnosť ich vlastností, takže identifikácia zlúčeniny ako izoelektronickej s inou, ktorá už bola chatakterizovaná, naznačuje jej možné vlastnosti a reaktivitu. Reaktivita však môže byť ovplyvnená rozdielmi vo vlastnostiach ako sú elektronegativita atómov.
V kvantovej mechanike sa ako atómy typu vodíka označujú ióny, ktoré majú len jeden elektrón, napríklad Li2+. Tieto ióny sa potom dajú označiť ako izoelektronické s vodíkom.
Príklady[upraviť | upraviť zdroj]
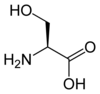 Serín |
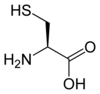 Cysteín |
 Selenocysteín |
| Tri izoelektronické aminokyseliny | ||
Atóm N a katión O+ sú izoelektronické, pretože oba majú päť valenčných elektrónov, alebo presnejšie, majú elektrónovú konfiguráciu [He] 2s2 2p3. Podobne sú katióny K+, Ca2+ a Sc3+ a anióny Cl-, S2- a P3- izoelektronické s atómom Ar.
CO, CN-, N2 a NO+ sú izoelektronické, pretože každá štruktúra má dva atómy viazané trojitou väzbou a kvôli náboju sú analogické v elektrónových konfiguráciách (elektrónová konfigurácia N- je identická s O, takže CO je elektronický s CN-).
Diagramy molekulárnych orbitálov najlepšie ilustrujú izoelektronicity dvojatómových molekúl, pretože zobrazujú miešanie atómových orbitálov izoelektronických látok, z ktorých vznikajú identické orbitálové kombinácie a teda i väzby.
Komplexnejšie molekuly môžu byť polyatomické. Aminokyseliny serín, cysteín a selenocysteín sú takisto navzájom izoelektronické (konkrétne valenčne izoelektornické). Líšia sa konkrétnym chalkogénom prítomným na konkrétnom mieste v bočnom reťazci.
 Acetón |
 Azometán |
| Tieto molekuly nie sú izoelektronické napriek tomu, že majú rovnakú elektrónovú konfiguráciu, pretože majú rôzne štruktúry. | |
Acetón CH3COCH3 a azometán CH3N2CH3 však nie sú izoelektronické. Majú rovnaký počet elektrónov, ale nemajú rovnakú štruktúru.
Referencie[upraviť | upraviť zdroj]
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "isoelectronic". DOI:10.1351/goldbook.I03276
- ↑ Isoelectronic Configurations Archivované 2017-07-17 na Wayback Machine iun.edu
- ↑ A. A. Aradi & T. P. Fehlner, "Isoelectronic Organometallic Molecules", in F. G. A. Stone & Robert West (eds.) Advances in Organometallic Chemistry Vol. 30 (1990), Chapter 5 (at p. 190) google books link
Zdroj[upraviť | upraviť zdroj]
Tento článok je čiastočný alebo úplný preklad článku Isoelectronicity na anglickej Wikipédii.
