Atomoxetín
| Atomoxetín | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C17H21NO |
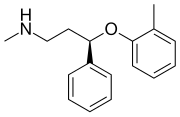
| Systematický názov | (R)-N-Metyl-3-fenyl-3-(o-tolyloxy)propán-1-amín |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 255,361 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 83015-26-3 82248-59-7 (soľ s HCl) |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Atomoxetín, predávaný napríklad pod názvom Strattera, je liečivo, ktoré sa používa na liečbu ADHD.[1][2] Môže sa používať osamote alebo s psychostimulantmi.[3][4] Takisto sa používa na zlepšenie kognitívnych schopností na zlepšenie bdelosti, pozornosti a pamäte.[5][6][7] Použitie atomoxetínu sa odporúča pre osoby, ktoré sú staršie ako 6 rokov.[1] Atomoxetín sa podáva perorálne.[1] Pre použitie v USA bol povolený v roku 2002.[1] V roku 2020 to bol 287. najčastejšie predpisovaný liek v USA a bol predpísaný viac ako miliónkrát.[8][9]
Medzi bežné vedľajšie účinky atomoxetínu patrí bolesť brucha, strata chuti do jedla, nevoľnosť, únava a závraty.[1] Medzi závažné vedľajšie účinky patrí angioedém, problémy s pečeňou, mŕtvica, psychóza, problémy so srdcom, agresia a samovražda.[1][10] Atomoxetín nesmú uživať pacienti so závažnými kardiovaskulárnymi alebo cerebrovaskulárnymi poruchami.[2] Neexistuje dostatok dát o jeho bezpečnosti počas tehotenstva – podľa údajov z roku 2019 nie je jasné, či je bezpečný počas tehostenstva a dojčenia.[11][12]
Atomoxetín spomaľuje spätné vychytávanie norepinefrínu a predpokladá sa, že pôsobí zvyšovaním hladiny norepinefrínu a dopamínu v mozgu.[1][13]
Referencie[upraviť | upraviť zdroj]
- ↑ a b c d e f g Atomoxetine Hydrochloride Monograph for Professionals [online]. American Society of Health-System Pharmacists. Dostupné online. Archivované 2019-04-04 z originálu.
- ↑ a b DÔLEŽITÉ INFORMÁCIE O BEZPEČNOSTI STRATTERY (ATOMOXETÍNU) A O RIZIKÁCH ZVÝŠENÉHO KRVNÉHO TLAKU A SRDCOVEJ FREKVENCIE. [online]. Eli Lilly Slovakia, [cit. 2022-10-08]. Dostupné online.
- ↑ A systematic review of combination therapy with stimulants and atomoxetine for attention-deficit/hyperactivity disorder, including patient characteristics, treatment strategies, effectiveness, and tolerability. Journal of Child and Adolescent Psychopharmacology, April 2013, s. 179–93. DOI: 10.1089/cap.2012.0093. PMID 23560600.
- ↑ Parent's Medication Guide: ADHD [online]. American Psychiatric Association & American Academy of Child and Adolescent Psychiatry (AACAP), June 2013. Dostupné online. Archivované 2017-02-02 z originálu.
- ↑ Molecular Neuropharmacology: A Foundation for Clinical Neuroscience. 3. vyd. New York : McGraw-Hill Medical, 2015. ISBN 9780071827706. 14: Higher Cognitive Function and Behavioral Control.
- ↑ Treatment of Attention-Deficit/Hyperactivity Disorder in Adolescents: A Systematic Review. JAMA, May 2016, s. 1997–2008. DOI: 10.1001/jama.2016.5453. PMID 27163988.
- ↑ Cognitive enhancement as a treatment for drug addictions. Neuropharmacology, January 2013, s. 452–63. DOI: 10.1016/j.neuropharm.2012.06.021. PMID 22735770.
- ↑ The Top 300 of 2020 [online]. clincalc.com, [cit. 2022-10-08]. Dostupné online.
- ↑ Atomoxetine - Drug Usage Statistics [online]. . Dostupné online. Archivované 2021-10-07 z originálu.
- ↑ British national formulary : BNF 76. 76. vyd. [s.l.] : Pharmaceutical Press, 2018. ISBN 9780857113382. S. 344–345.
- ↑ Atomoxetine Pregnancy and Breastfeeding Warnings [online]. . Dostupné online. Archivované 2019-03-22 z originálu.
- ↑ SAUER, John-Michael; RING, Barbara J.; WITCHER, Jennifer W.. Clinical Pharmacokinetics of Atomoxetine. Clinical Pharmacokinetics, 2005-06-01, roč. 44, čís. 6, s. 571–590. Dostupné online [cit. 2022-10-08]. ISSN 1179-1926. DOI: 10.2165/00003088-200544060-00002. (po anglicky)
- ↑ Clinical pharmacokinetics of atomoxetine. Clinical Pharmacokinetics, 2005, s. 571–90. DOI: 10.2165/00003088-200544060-00002. PMID 15910008.
Zdroj[upraviť | upraviť zdroj]
Tento článok je čiastočný alebo úplný preklad článku Atomoxetine na anglickej Wikipédii.
