Vodíková väzba
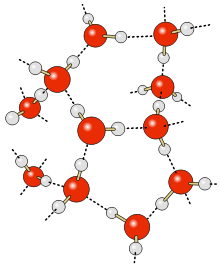
Vodíková väzba alebo vodíkový mostík je druh slabej interakcie medzi molekulami. Je silnejšia ako väčšina ostatných medzimolekulových síl, ale je podstatne slabšia ako iónová väzba alebo kovalentná väzba.
Vznik vodíkovej väzby[upraviť | upraviť zdroj]
Pretože atóm vodíka má iba jeden elektrón, dochádza pri vytvorení väzby k elektronegatívnemu prvku k značnému odhaleniu atómového jadra. Vzniknutý parciálny kladný náboj na atóme vodíka viaže neväzbové elektrónové páry okolitých molekúl (v prípade intramolekulových väzieb ide o elektrónové páry rovnakej molekuly).
Vznik vodíkovej väzby je možný iba u veľmi elektronegatívnych prvkov, ako je napríklad fluór, kyslík a dusík. Jedine tieto tri prvky sú schopné v dostatočnej miere odčerpať elektrónovú hustotu od atómu vodíka.
Energia vodíkovej väzby[upraviť | upraviť zdroj]
Najslabšie vodíkové väzby majú energiu 1 - 2 kJ.mol-1, najsilnejšie dosahujú energiu okolo 40 kJ.mol-1 (u aniónov HF2-). Diaľka vodíkovej väzby závisí na energii väzby, teplote a tlaku. Typická diaľka vodíkovej väzby vo vode je 1,97 Å.
Zmeny fyzikálnych vlastností látok v dôsledku vodíkovej väzby[upraviť | upraviť zdroj]
Vodíková väzba spôsobuje zväčšenie medzimolekulových príťažlivých síl, čo silne ovplyvňuje fyzikálno - chemické vlastnosti systému (teplota varu a teplota topenia, hustotu, viskozitu, atď.). Vďaka vodíkovej väzbe má voda teplotu varu 100 °C, zatiaľ čo sulfán (ktorý vodíkové väzby nevytvára) vrie pri teplote -60 °C.
Iné projekty[upraviť | upraviť zdroj]
 Commons ponúka multimediálne súbory na tému Vodíková väzba
Commons ponúka multimediálne súbory na tému Vodíková väzba
