Fenolftaleín
| Fenolftaleín | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C20H14O4 |
| Systematický názov | 3,3-bis(4-hydroxyfenyl)1(3H)izobenzofuranón |
| Synonymá | 3,3-bis(4-hydroxyfenyl)-1(3H)-izobenzofuranón |
| Vzhľad | bezfarebná tuhá látka |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 318,323 g/mol |
| Teplota topenia | 262,5 °C |
| Hustota | 1,277 g/cm3 (32 °C) |
| Ďalšie informácie | |
| Číslo CAS | 77-09-8 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Fenolftaleín je organická aromatická zlúčenina. Často sa používa pri acidobázických titráciách ako indikátor. Počas titrácie totiž mení farbu pri prechode z kyslého prostredia (kde je bezfarebný) do zásaditého prostredia (kde je ružový). Patrí medzi farbivá známe ako ftaleínové farbivá.
Vlastnosti[upraviť | upraviť zdroj]
Fenolftaleín je málo rozpustný vo vode a zvyčajne sa pri experimentoch rozpúšťa v alkoholoch. Je to slabá kyselina, ktorá je schopná v roztoku odštiepiť ióny H+. Neionizovaná forma fenolftaleínu je bezfarebná, zatiaľ čo protónovaná forma je oranžová a deprotónovaná forma je fialová. Pri pridaní zásady do roztoku s fenolftaleínom sa posunie rovnováha medzi neionizovanou a deprotónovanou formou, pretože zásada odoberá ióny H+ z roztoku, čo má za následok zmenu farby.
Výroba[upraviť | upraviť zdroj]
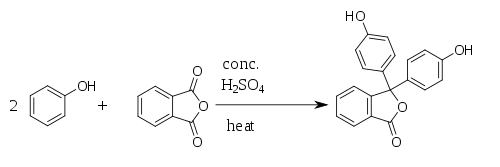
Fenolftaleín bol prvýkrát pripravený v roku 1871 nemeckým chemikom Adolf von Baeyerom.[1][2][3] Fenolfatelín je možné pripraviť reakciou fenolu s ftalanhydridom,[4] z čoho pochádza názov fenolftaleín. Reakcia prebieha za katalýzy kyseliny sírovej a za tepla, ale nesmie dôjsť k prehriatiu, pretože by sa ftalanhydrid rozpadol. Pri reakcii vzniká ako vedľajší produkt voda.
Reakciu je možné katalyzovať zmesou chloridu zinočnatého a tionylchloridu.[5]
Titrácie[upraviť | upraviť zdroj]

Bežným použitím fenolftaleínu je jeho využitie ako indikátor pre acidobázické titrácie. Pri acidobázických titráciách sa využíva farebný prechod fenolftaleínu pri zmene pH. V kyslom prostredí je fenolftaleín bezfarebný, v bazickom prostredí sa sfarbuje do fialova. K prechodu dochádza pri pH 8,2-9,8. Fenolftaleín sa používa vo forme roztoku v etanole. Fenolftaleín je takisto súčasťou univerzálneho indikátoru, ktorý tvorí spolu s metylovou červenou, brómtymolovou modrou a tymolovou modrou.[6]
Fenolftaleín má aspoň štyri rôzne formy vo vodnom roztoku, ktoré sa menia podľa prítomného pH.[7] Vo veľmi kyslých roztokoch existuje v protónovanej forme, H3In+, a má oranžové sfarbenie. Medzi veľmi kyslým a mierne zásaditým pH existuje v podobe bezfarebného laktónu (H2In). Dvakrát deprotónovaná fenolátová forma (In2-) ma ružovú až fialovú farbu. Vo veľmi zásaditých roztokoch sa mení na hydroxylovanú formu (In(OH)3−), ktorá veľmi pomaly bledne[chýba zdroj] a pri pH nad 13 je úplne bezfarebná.
| Zlúčenina | H3In+ | H2In | In2− | In(OH)3− |
|---|---|---|---|---|
| Štruktúra |  |
 |
 |

|
| Model |  |
 |
 |

|
| pH | < -1[7] | 0−8,2 | 8,3-10,0[8] | >10,0 |
| Prostredie | silne kyslé | kyslé alebo skoro neutrálne | alkalické | silne alkalické |
| Farba | oranžová | ružová až fialová | bezfarebná | |
| Obrázok |  |
 |

|
| Animácia ukazujúcia reakčný mechanizmus závislý na pH: H3In+ → H2In → In2− → In(OH)3− |
Využitie[upraviť | upraviť zdroj]
Hračky a zábava[upraviť | upraviť zdroj]
Ďalšie použitie je pri výrobe hračiek, napr. miznúcich atramentov.[9] Atrament sa zmieša s hydroxidom sodným, ktorý reaguje so vzdušným oxidom uhličitým. Pri reakcii vzniká uhličitan sodný a ióny H+, vďaka ktorým klesá pH atramentu:
OH− + CO2 → CO32− + H+
Pokles pH spôsobí prechod fenolftaleínu z fialovej do bezfarebnej formy. Farba postupne zanikne kvôli reakcii s vzdušným oxidom uhličitým. Podobným spôsobom sa využíva tymolftaleín, keď je žiadaná modrá farba namiesto ružovej.[9]
Betón[upraviť | upraviť zdroj]
Senzitivita fenolftaleínu na pH sa používa i pri iných aplikáciách. Betón má zvyčajne vysoké pH kvôli prítomnému hydroxidu vápenatému, ktorý vzniká pri miešaní Portlandského cementu s vodou. Keď betón reaguje s oxidom uhličitým v atmosfére, jeho pH sa znižuje na 8,5-9. Keď sa na bežný betón aplikuje 1% roztok fenolftaleínu, zmení farbu na jasne ružovú. Ak však ostane bezfarebný, znamená to, že betón bol nasýtený oxidom uhličitým. Podobný proces prebieha pri úprave dier v sadrokatónových stenách.[10]
Výuka[upraviť | upraviť zdroj]
Okrem acidobázických titrácií sa pomalý farebný prechod fenolftaleínu pri zmene z In2- na In(OH)3- využíva na hodinách chémie na štúdium reakčnej kinetiky.[chýba zdroj]
Využitie v medicíne[upraviť | upraviť zdroj]
Fenoltaleín sa používa ako preháňadlo. V súčasnej dobe sa od jeho použitia ustupuje[11] z dôvodu možnej karcinogenity.[12][13] Laxatívne prípravky, ktoré obsahovali fenolftaleín, majú pozmenenú receptúru, aby obsahovali náhradné aktívne látky: Feen-a-Mint[14] namiesto neho využíva bisakodyl a Ex-Lax[15] namiesto neho využíva výťažok zo seny. Podobným laxatívom je tymolftaleín vyrábaný z tymolu.
Napriek obavám z jeho karcinogenicity je nepravdepodobné, že fenolftaleín používaný ako preháňadlo spôsobí rakovinu vaječníkov.[16] Bolo zistené, že fenolftaleín u ľudí inhibuje vstup vápnika do buniek.[17] Fenolftaleín bol pridaný Európskou chemickou agentúrou na zoznam kandidátskych látok vzbudzujúcich veľmi veľké obavy.[18]
Redukovaná forma fenolftaleínu, fenolftalín, ktorý je bezfarebný, sa používa pri testovaní prítomnosti krvi, tzv. Kastle-Meyerov test.[19] K suchej vzorke sa pridá pár kvapiek alkoholu, potom pár kvapiek fenolftalínu a nakoniec pár kvapiek peroxidu vodíka. Ak vzorka obsahuje hemoglobín, vzorka zmení farbu na fialovú okamžite po pridaní peroxidu, pretože vznikne fenolftaleín. Pozitívny test indikuje hemoglobín a na základe toho sa pravdepodobne jedná o krv. Falošne pozitívny test vzniká pri prítomnosti látok s podobnou katalytickou aktivitou, akú má hemoglobín. Test nie je deštruktívny, takže vzorku je možné ponechať a použiť na ďalšie testy. Prítomnosť hydroxidu sodného v činidlách však poškodzuje prítomnú DNA.[19] Tento test dáva rovnaké výsledky pre krv z akéhokoľvek zvieraťa, ktorého krv obshuje hemoglobín, vrátane takmer všetkých stavovcov. Ďalšie testy by boli nutné na presné určenie toho, či sa jedná o ľudskú krv.
Referencie[upraviť | upraviť zdroj]
- ↑ Baeyer, A.. Ueber eine neue Klasse von Farbstoffen. Berichte der Deutschen Chemischen Gesellschaft, 1871, s. 555–558. Dostupné online. DOI: 10.1002/cber.18710040209.
- ↑ Baeyer, A.. Ueber die Phenolfarbstoffe. Berichte der Deutschen Chemischen Gesellschaft, 1871, s. 658–665. Dostupné online. DOI: 10.1002/cber.18710040247.
- ↑ Baeyer, A.. Ueber die Phenolfarbstoffe. Polytechnisches Journal, 1871, s. 358–362. Dostupné online. Archivované 2019-05-04 na Wayback Machine
- ↑ Patent v USA 2192485
- ↑ Patent v USA 2522939
- ↑ Universal Indicator [online]. ISCID Encyclopedia of Science and Philosophy, [cit. 2022-01-26]. Archivované z originálu 25.9.2006. Dostupné online. Archivované 2006-09-25 z originálu.
- ↑ a b Reactions of phenolphthalein at various pH values. Journal of Chemical Education, 1 March 1983, s. 239. ISSN 0021-9584. DOI: 10.1021/ed060p239.
- ↑ Is this Solution Pink Enough? A Smartphone Tutor to Resolve the Eternal Question in Phenolphthalein-Based Titration. Journal of Chemical Education, 20 February 2019, s. 486–494. DOI: 10.1021/acs.jchemed.8b00708.
- ↑ a b KATZ, David A.. Chemistry in the toy store [online]. [Cit. 2022-01-26]. Dostupné online.
- ↑ Patent v USA 6531528
- ↑ Spiller, H. A.; Winter, M. L.; Weber, J. A.. Skin Breakdown and Blisters from Senna-Containing Laxatives in Young Children. The Annals of Pharmacotherapy, May 2003, s. 636–639. DOI: 10.1345/aph.1C439. PMID 12708936.
- ↑ Dunnick, J. K.; Hailey, J. R.. Phenolphthalein Exposure Causes Multiple Carcinogenic Effects in Experimental Model Systems. Cancer Research, 1996, s. 4922–4926. Dostupné online. PMID 8895745.
- ↑ Tice, R. R.; Furedi-Machacek, M.; Satterfield, D.. Measurement of Micronucleated Erythrocytes and DNA Damage during Chronic Ingestion of Phenolphthalein in Transgenic Female Mice Heterozygous for the p53 Gene. Environmental and Molecular Mutagenesis, 1998, s. 113–124. DOI: 10.1002/(SICI)1098-2280(1998)31:2<113::AID-EM3>3.0.CO;2-N. PMID 9544189.
- ↑ Phenolphthalein [online]. . Dostupné online.
- ↑ STOLBERG, Sheryl Gay. 3 Versions of Ex-Lax Are Recalled After F.D.A. Proposes Ban on Ingredient [online]. August 30, 1997. Dostupné online.
- ↑ COOPER, G. S.; Longnecker, M. P.; Peters, R. K.. Ovarian Cancer Risk and Use of Phenolphthalein-Containing Laxatives. Pharmacoepidemiology and Drug Safety, 2004, s. 35–39. Dostupné online. DOI: 10.1002/pds.824. PMID 14971121.
- ↑ DOBRYDNEVA, Y.; Wilson, E.; Abelt, C. J.. Phenolphthalein as a Prototype Drug for a Group of Structurally Related Calcium Channel Blockers in Human Platelets. Journal of Cardiovascular Pharmacology, 2009, s. 231–240. DOI: 10.1097/FJC.0b013e31819b5494. PMID 19247192.
- ↑ Phenolphthalein - Substance Information - ECHA [online]. . Dostupné online. (po anglicky)
- ↑ a b SLOOTS, James; LALONDE, Wendy; REID, Barbara. Kastle–Meyer blood test reagents are deleterious to DNA. Forensic Science International, 2017-12-01, roč. 281, s. 141–146. Dostupné online [cit. 2022-01-26]. ISSN 0379-0738. DOI: 10.1016/j.forsciint.2017.10.006. (po anglicky)
Pozri aj[upraviť | upraviť zdroj]
Zdroj[upraviť | upraviť zdroj]
- Tento článok je čiastočný alebo úplný preklad článku Phenolphtalein na anglickej Wikipédii.