Polarita (chémia)
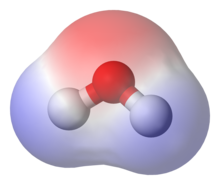
Polarita v chémii opisuje nerovnomerné rozloženie elektrického náboja v molekule. Táto vlastnosť je charakterizovaná elektrickým dipólovým momentom.[1] Molekuly sa podľa toho delia na polárne molekuly, teda tie, ktoré majú nenulový dipólový moment (majú asymetrické rozloženie nábojov), a nepolárne molekuly, teda tie, ktoré nemajú dipólový moment (rozloženie nábojov je symetrické).[1]
Rozloženie náboja je možné opisovať na úrovni jednotlivých väzieb alebo na úrovni celej molekuly. Celková polarita molekuly je potom sumou polarít jednotlivých väzieb.[1]
Polarita väzieb
[upraviť | upraviť zdroj]Polarita kovalentných väzieb je daná elektronegativitou atómov, ktoré ju tvoria. Ak je väzba tvorená dvoma atómami, ktoré majú rovnakú elektronegativitu, je rozloženie elektrónov symetrické a väzba sa označuje ako nepolárna. V prípade, že je väzba tvorená atómami s rozličnými elektronegativitami, väzba sa označuje ako polárna, pretože rozloženie náboja je nesymetrické.[2]
Medzimolekulové sily
[upraviť | upraviť zdroj]Polarita molekuly úzko súvisí s príťažlivými silami, ktoré pôsobia medzi rôznymi molekulami. V prípade polárnych látok dochádza k natočeniu jednotlivých molekúl tak, aby sa ich opačne nabité póly priťahovali. Jednotlivé dipóly sa teda orientujú rovnakým smerom. V prípade interakcie polárnych látok s nepolárnymi dochádza k tomu, že v nepolárnej molekule sa pôsobením polárnej molekuly vytvorí (indukuje) dočasný dipólový moment. Potom je situácia podobná, ako u dvoch polárnych molekúl. V prípade interakcie medzi dvoma nepolárnymi látkami potom dochádza k vytvoreniu okamžitých dipólov na základe toho, že sa elektróny pohybujú okolo jadier a niekedy dochádza k ich oddialeniu, takže dočasne vzniká dipólový moment. Tento dipólový moment vyvoláva dipólový moment v druhej nepolárnej molekule, na základe čoho vzniká elektrostatická interakcia. Všetky tieto sily sú teda príťažlivé, líšia sa len svojou silou a časovým obmedzením.[1]
Rozpustnosť
[upraviť | upraviť zdroj]Jednou z dôležitých vlastností, ktoré sú dané polaritou látok, je ich rozpustnosť. Polárne látky sa dobre rozpúšťajú v polárnych rozpúšťadlách a naopak.[1]
Pôsobenie elektrického poľa
[upraviť | upraviť zdroj]Vložením molekuly do vonkajšieho elektrického poľa dochádza k polarizácii molekúl, teda deformácii molekúl na základe pôsobenia poľa. Vonkajšie elektrické pole spôsobuje posun elektrónov v molekule, posun atómových jadier i zmenu relatívneho rozloženia jadier či skupín v molekule. V prípade polárnych molekúl, ktoré majú permanentný (stály) dipólový moment, navyše dochádza k orientácii molekuly podľa smeru vonkajšieho poľa.[1] Schopnosť látky polarizovať vo vonkajšom elektrickom poli sa označuje ako polarizovateľnosť.[3] Polarizovateľnosť pre nepolárne molekuly opisuje Clausiusova-Mossotiho rovnica. Pre polárne látka táto rovnica neplatí kvôli tepelnému pohybu molekúl, ktorý ovplyvňuje schopnosť molekúl orientovať sa podľa pôsobiaceho poľa.[1][3]
Orientáciou a deformáciou rozloženia náboja v molekule dochádza k oslabeniu vonkajšieho elektrického poľa, pretože molekula tvorí vlastné elektrické pole s opačným smerom. Zoslabenie elektrického poľa potom opisuje permitivita (alebo aj dielektrická konštanta).[1]
Referencie
[upraviť | upraviť zdroj]- ↑ a b c d e f g h GAŽO, Ján. Všeobecná a anorganická chémia. Bratislava : Alfa, 1974. S. 142 – 148, 201 – 211.
- ↑ chemická väzba. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 317.
- ↑ a b polarizácia molekúl. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 532.
