Pentózafosfátová dráha

Pentózafosfátová dráha,[1][2] známa i ako pentózafosfátová cesta,[3][4] fosfoglukonátová cesta,[3] pentózafosfátový skrat,[4] priama oxidácia glukózy[4] či hexózamonofosfátový skrat,[3][5][6] je metabolická dráha paralelná ku glykolýze.[7] Niekedy sa označuje i ako pentózový cyklus,[3][4][5][6] avšak nejde o uzavretý sled reakcií, kde v poslednej reakcii vzniká prekurzor prvej reakcie. V pentózafosfátovej dráhe sa tvorí NADPH,[2] pentózy (päťuhlíkové cukry)[2] a ribóza-5-fosfát, ktorá je prekurzorom pre syntézu nukleotidov.[4][8] Táto dráha síce začína oxidáciou glukózy, ale je to skôr anabolická dráha než katabolická. Táto dráha je obzvlášť dôležitá u červených krviniek.
Pentózafosfátová dráha sa skladá z dvoch rozdielnych fáz, resp. častí. Prvou je oxidačná fáza (nevratná časť[4]), v ktorej sa tvorí NADPH, a druhou je neoxidačná (vratná časť[4]), kde dochádza k syntéze pentóz. U väčšiny organizmov prebieha pentózafosfátová dráha v cytozole, u rastlín prebieha väčšina reakcií v plastidoch.[9]
Podobne ako glykolýza, i pentózafosfátová dráha vyzerá byť evolučne veľmi stará. Reakcie tejto dráhy sú v moderných bunkách prevažne katalyzované enzýmami, ale takisto prebiehajú neenzymaticky v podmienkach, ktoré napodobňujú praveký oceán a sú katalyzované iónmi kovov, predovšetkým železnatými iónmi, Fe2+.[10] Na základe toho sa predpokladá, že táto dráha mohla vzniknúť už v prebiotickom svete.
Produkty dráhy
[upraviť | upraviť zdroj]Hlavnou úlohou dráhy je:
- tvorba redukčných ekvivalentov v podobe NADPH, ktoré sa ďalej využívajú v reduktívnej biosyntéze v bunkách (napr. syntéza mastných kyselín).
- tvorba ribóza-5-fosfátu, ktorý sa používa v syntéze nukleotidov a nukleových kyselín.
- tvorba erytróza-4-fosfátu, ktorý sa používa v syntéze aromatických aminokyselín.
Pentózy prijaté v potrave z nukleových kyselín môžu byť metabolizované pentózafosfátovou dráhou. Uhlíkové kostry sacharidov sa môžu premeniť na glykolytické/glukoneogenické intermediáty (intermediáty vystupujúce v glykolýze a glukoneogenéze).
Aromatické aminokyseliny sú zase prekurzormi v mnohých biosyntetických dráhach, napríklad syntézy lignínu a dreva.[chýba zdroj]
U cicavcov prebieha pentózafosfátová dráha výhradne v cytoplazme. U ľudí prebieha hlavne v pečeni, mliečnych žľazách a kôre nadobličiek.[chýba zdroj] Táto dráha je jedným z troch hlavných spôsobov tvorby redukčných ekvivalentov a u ľudí sa ňou tvorí asi 60 % celkového NADPH.[chýba zdroj]
Jedno z použití NADPH je zabránenie oxidačnému stresu buniek. NADPH redukuje glutatión pomocou glutatiónreduktázy, ktorá premieňa reaktívny peroxid vodíka, H2O2, na vodu pomocou glutatiónperoxidázy. Ak by glutatiónperoxidáza nebola prítomná, peroxid vodíka by sa zmenil na voľný hydroxylový radikál, ktorý môže poškodiť bunku. Erytrocyty tvoria veľké množstvo NADPH pomocou pentózafosfátovej dráhy na použitie v redukcii glutatiónu.
Peroxid vodíka sa takisto tvorí fagocytmi v procese zvanom respiračné vzplanutie.[11]
Fázy dráhy
[upraviť | upraviť zdroj]Oxidačná fáza
[upraviť | upraviť zdroj]V oxidačnej fáze (nevratná časť[4]) sa redukujú dve molekuly NADP+ na NADPH, na čo sa využíva energia z konverzie glukóza-6-fosfátu na ribulóza-5-fosfát. Pentózafosfátová dráha sa takisto nazýva priama oxidácia glukózy práve kvôli týmto reakciám, pretože na rozdiel od glykolýzy dochádza ihneď k oxidácii glukózy, zatiaľ čo v glykolýze dochádza k oxidácii až v druhej časti dráhy a oxidujú sa trojuhlíkové medziprodukty.[4]

1 - Glukóza-6-fosfát
2 - 6-Fosfoglukono-δ-laktón
3 - 6-Fosfoglukonát
4 - Ribulóza-5-fosfát a oxid uhličitý
Tento sled reakcií sa dá sumarizovať nasledovne:
| Reaktanty | Produkty | Enzým | Opis reakcie |
| glukóza-6-fosfát + NADP+ | 6-fosfoglukonolaktón + NADPH | glukóza-6-fosfátdehydrogenáza | Dehydrogenácia. Hydroxylová skupina na uhlíku 1 glukóza-6-fosfátu sa mení na karbonyl, čím vzniká laktón a v procese sa tvorí NADPH. |
| 6-fosfoglukonolaktón + H2O | 6-fosfoglukonát + H+ | glukónolaktonáza | Hydrolýza laktónu. |
| 6-fosfoglukonát + NADP+ | ribulóza-5-fosfát + NADPH + CO2 | fosfoglukonátdehydrogenáza | Oxidačná dekarboxylácia. NADP+ je akceptor elektrónov a tvorí sa z neho ďalšia molekula NADPH. V procese vzniká oxid uhličitý a ribulóza-5-fosfát. |
Celková reakcie je teda:
- glukóza-6-fosfát + 2 NADP+ + H2O → ribulóza-5-fosfát + 2 NADPH + 2 H+ + CO2
Neoxidačná fáza
[upraviť | upraviť zdroj]V druhej fáze dochádza k premene troch molekúl pentózy na dve molekuly hexózy a jednu molekulu triózy, ktoré ďalej vstupujú do glykolýzy či iných dráh.
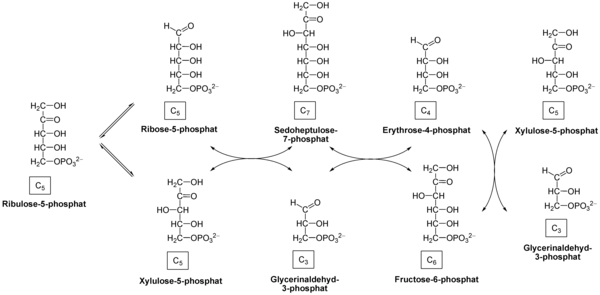
Tento sled reakcií sa dá sumarizovať nasledovne:
| Reaktanty | Produkty | Enzým |
| ribulóza-5-fosfát | ribóza-5-fosfát | ribózafosfátizomeráza |
| ribulóza-5-fosfát | xylulóza-5-fosfát | ribulózafosfátepimeráza |
| xylulóza-5-fosfát + ribóza-5-fosfát | glyceraldehyd-3-fosfát + sedoheptulóza-7-fosfát | transketoláza |
| glyceraldehyd-3-fosfát + sedoheptulóza-7-fosfát | erytróza-4-fosfát + fruktóza-6-fosfát | transaldoláza |
| xylulóza-5-fosfát + erytróza-4-fosfát | glyceraldehyd-3-fosfát + fruktóza-6-fosfát | transketoláza |
Celková reakcie je teda:
- 3 ribulóza-5-fosfát → ribóza-5-fosfát + 2 xylulóza-5-fosfát → 2 fruktóza-6-fosfát + glyceraldehyd-3-fosfát
Regulácia
[upraviť | upraviť zdroj]Glukóza-6-fosfátdehydrogenáza (G6PD) je enzým, ktorý určuje rýchlosť tejto reakcie. Je alostericky stimulovaná NADP+ a silne inhibovaná NADPH.[12] Pomer NADPH/NADP+ je bežne v cytozole v pečeni okolo 100.[chýba zdroj] Cytozol je teda silne redukčné prostredie. Dráhy, v ktorých z NADPH vzniká NADP+, stimulujú G6PD, ktorá následne tvorí NADPH. Tento krok je takisto inhibovaný acetyl-CoA.[chýba zdroj]
Aktivita G6PD je takisto posttranslačne regulovaná cytoplazmatickou deacetylázou SIRT2. Deacetylácia sprostredkovaná SIRT2 a aktivácia G6PD stimuluje oxidačnú fázu pentózafosfátovej dráhy, čím vzniká cytozolový NADPH, ktorý pôsobí proti oxidačnému poškodeniu alebo podporuje de novo lipogenézu.[13][14]
Červené krvinky
[upraviť | upraviť zdroj]U ľudí stredomorského a afrického pôvodu bolo pozorované spojenie niekoľkých porúch aktivity glukóza-6-fosfátdehydrogenázy a odolnosti proti parazitovi Plasmodium falciparum, ktorý spôsobuje maláriu. Základ tejto odolnosti pravdepodobne spočíva v oslabení membrány červených krviniek (parazit prežíva v červených krvinkách), ktoré kvôli tomu nie sú schopné udržať parazita pri živote dostatočne dlho na to, aby sa rozmnožil.[15]
Referencie
[upraviť | upraviť zdroj]- ↑ Energetický metabolismus rostlin [online]. kfrserver.natur.cuni.cz, [cit. 2022-01-02]. Dostupné online. Archivované 2022-01-02 z originálu.
- ↑ a b c ŠPRT. Syntéza mastných kyselín [online]. 2021-03-15, [cit. 2022-01-02]. Dostupné online.
- ↑ a b c d VODRÁŽKA, Zdeněk. Biochemie. Praha : Academia, 1996. (2., opr. vyd.) Dostupné online. ISBN 80-200-0600-1. S. 2/57.
- ↑ a b c d e f g h i Pentózový cyklus - Biochem helper [online]. sites.google.com, [cit. 2022-01-02]. Dostupné online. Archivované 2022-01-02 z originálu.
- ↑ a b SR, MEFANET, síť lékařských fakult ČR a. Pentózový cyklus – WikiSkripta [online]. www.wikiskripta.eu, [cit. 2022-01-02]. Dostupné online. (po česky)
- ↑ a b ŠKÁRKA, Bohumil; FERENČÍK, Miroslav. Biochémia. 3. vyd. [s.l.] : [s.n.], 1992. ISBN 80-05-01076-1. S. 158.
- ↑ The Pentose Phosphate Pathway Dynamics in Cancer and Its Dependency on Intracellular pH. Metabolites, 2020, s. 285. DOI: 10.3390/metabo10070285. PMID 32664469. (po anglicky)
- ↑ The Pentose Phosphate Pathway Dynamics in Cancer and Its Dependency on Intracellular pH. Metabolites, 2020, s. 285. DOI: 10.3390/metabo10070285. PMID 32664469. (po anglicky)
- ↑ The oxidative pentose phosphate pathway: structure and organisation. Current Opinion in Plant Biology, June 2003, s. 236–246. DOI: 10.1016/S1369-5266(03)00039-6. PMID 12753973.
- ↑ Non-enzymatic glycolysis and pentose phosphate pathway-like reactions in a plausible Archean ocean. Molecular Systems Biology, 25 April 2014, s. 725. DOI: 10.1002/msb.20145228. PMID 24771084.
- ↑ GÓRSKI, Andrzej; MIĘDZYBRODZKI, Ryszard; BORYSOWSKI, Jan. Chapter 2 - Phage as a Modulator of Immune Responses: Practical Implications for Phage Therapy. Zväzok 83. [s.l.] : Academic Press, 2012-01-01. (Bacteriophages, Part B.) DOI: 10.1016/B978-0-12-394438-2.00002-5. Dostupné online. S. 41–71. (po anglicky)
- ↑ Voet Donald; Voet Judith G. Biochemistry. 4th. vyd. [s.l.] : [s.n.], 2011. ISBN 978-0470-57095-1. S. 894.
- ↑ Regulation of G6PD acetylation by SIRT2 and KAT9 modulates NADPH homeostasis and cell survival during oxidative stress. EMBO Journal, June 2014, s. 1304–20. DOI: 10.1002/embj.201387224. PMID 24769394.
- ↑ SIRT2 activates G6PD to enhance NADPH production and promote leukaemia cell proliferation. Sci Rep, Sep 2016, s. 32734. DOI: 10.1038/srep32734. PMID 27586085.
- ↑ Early phagocytosis of glucose-6-phosphate dehydrogenase (G6PD)-deficient erythrocytes parasitized by Plasmodium falciparum may explain malaria protection in G6PD deficiency. Blood, October 1998, s. 2527–34. DOI: 10.1182/blood.V92.7.2527. PMID 9746794.
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Pentose phosphate pathway na anglickej Wikipédii.
