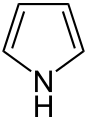
Furán
| Furán | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C4H4O |
| Systematický názov | Furán |
| Vzhľad | bezfarebná kvapalina |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 68,07 g/mol |
| Teplota topenia | −85,6 °C |
| Teplota varu | 31,4 °C |
| Hustota | 0,936 g/cm3 |
| pKA | 35,6[1] |
| Ďalšie informácie | |
| Číslo CAS | 110-00-9 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Furán je heterocyklická organická zlúčenina s jedným atómom kyslíka v päťčlánkovom cykle. Je to aromatická zlúčenina. Za normálnych podmienok je to priehľadná, veľmi prchavá, horľavá kvapalina s teplotou varu blízkej izbovej teplote (31,4 °C).
Furán je toxický a karcinogénny. Jeho katalytickou hydrogenáciou v prítomnosti paládia vzniká tetrahydrofurán. V kyslom prostredí je nestabilný a polymerizuje.[2]
Syntéza[upraviť | upraviť zdroj]
Bežne sa furán pripravuje Feistovou-Benaryho syntézou. Ide o reakciu α-halogénketónov s β-dikarbonylovými zlúčeninami. Vyjadruje ju nasledovná schéma:

Veľmi jednoduchý spôsob výroby furánu je reakcia 1,4-diketónov s oxidom fosforečným podľa Paalovej-Knorrovej syntézy.
Reakcie[upraviť | upraviť zdroj]
Kvôli jeho aromatickosti reaguje furán veľmi odlišne od ostatných heterocyklických éterov, ako je tetrahydrofurán. V elektrofilných substitučných reakciách je podstatne reaktívnejší ako benzén. Substituenty sa prednostne naväzujú do polôh 2 a 5.
Furán môže vstupovať do Dielsovej-Alderovej reakcie, napríklad:

Furán možno katalyticky v prítomnosti paládia hydrogenovať na dihydrofurán a tetrahydrofurán.
Biochemický význam[upraviť | upraviť zdroj]
Podľa furánu sú pomenované furanózy, cyklické formy sacharidov, ktoré majú päť atómov v kruhu. Furanózy však nemajú aromatický kruh a ich základom je v skutočnosti tetrahydrofurán.
Podobné zlúčeniny[upraviť | upraviť zdroj]
Látky obsahujúce furánový cyklus[upraviť | upraviť zdroj]
Analógy furánu[upraviť | upraviť zdroj]
Iné podobné zlúčeniny[upraviť | upraviť zdroj]
Referencie[upraviť | upraviť zdroj]
- ↑ BARAN, Phil. Essentials of Heterocyclic Chemistry-I [online]. [Cit. 2022-09-21]. Dostupné online. Archivované 2023-03-14 z originálu.
- ↑ furán. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 268.