Kyselina mevalónová
| Kyselina mevalónová | |
 | |
 | |
| Všeobecné vlastnosti | |
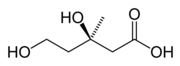
| Sumárny vzorec | C6H12O4 |
| Synonymá | Kyselina (3R)-3,5-dihydroxy-3-metylpentánová, mevalonát, (R)-mevalonát |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 148,158 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 150-97-0 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Kyselina mevalónová[1] je organická zlúčenina. Jej názov je skrátenou verziou mena dihydroxymetylvalerolaktón. V biologických systémoch je zastúpená hlavne jej konjugovanou bázou, ktorá sa nazýva mevalonát. Mevalonát je dôležitou zlúčeninou v biochémii a farmácií. Niektoré lieky, napr. statíny (ktoré znižujú hladinu cholesterolu), zastavujú tvorbu mevalonátu vďaka inhibícii HMG-CoA reduktázy.[2] Mevalonát je chirálny a iba (3R)-enantiomér je biologicky aktívny.
Chemické vlastnosti
[upraviť | upraviť zdroj]Kyselina mevalónová je dobre rozpustná vo vode a polárnych organických rozpúšťadlách. V roztoku je prítomná v rovnováhe s jej laktónom, ktorý sa nazýva mevalonolaktón. Mevalonolaktón vzniká kondenzáciou koncovej alkoholovej skupiny s karboxylovou funkčnou skupinou.
Význam v biológii
[upraviť | upraviť zdroj]Mevalonát je prekurzor v biosyntetickej dráhe známej ako mevalonátová dráha, ktorou vznikajú terpény a steroidy. Mevalonát je hlavný prekurzor izopentenylpyrofosfátu (IPP), ktorý je základom všetkých terpenoidov. V tejto dráhe vzniká (R)-enantiomér.

Referencie
[upraviť | upraviť zdroj]- ↑ ŠKÁRKA, Bohumi; FERENČÍK, Miroslav. Biochémia. Bratislava : Alfa, 1987. Dostupné online. ISBN 80-05-01076-1. S. 231.
- ↑ Endo, A.. The discovery and development of HMG-CoA reductase inhibitors. Journal of Lipid Research, 1992, s. 1569–1582. PMID 1464741.
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Mevalonic acid na anglickej Wikipédii.
