Dimér (chémia)

Dimér (di-, „dva“ + -mer, „časti“) je oligomér, ktorý pozostáva z dvoch monomérov spojenými väzbami, ktoré môžu byť silné alebo slabé, kovalentné alebo intermolekulárne. Homodimér je druh diméru, kde sú obe monomérne jednotky rovnaké (napr. A–A) a heterodimér má dve rôzne monomérne jednotky (napr. A–B). Tvorba diméru sa nazýva dimerizácia,[1] teda látka A dimerizuje za tvorby diméru A-A. Opak dimerizácie sa často nazýva disociácia. Ak sa dva opačne nabité ióny asociujú do diméru, nazývajú sa i Bjerrumove páry,[2] po Nielsovi Bjerrumovi.
Nekovalentné diméry
[upraviť | upraviť zdroj]Bezvodé karboxylové kyseliny tvoria diméry vďaka vodíkovým väzbám kyslému vodíka a karbonylovému kyslíku. Kyselina octová napríklad tvorí dimér v plynnej fáze, kde sú monomérne jednotky držané pokope práve vodíkovými väzbami. Pri špeciálnych podmienkach tvorí diméry väčšina molekúl, ktoré obsahujú hydroxylovú skupinu, napríklad existuje i vodný dimér.
Borán, BH3, existuje i v podobe diboránu, B2H6, kvôli vysokej Lewisovej kyslosti bórového centra.
Exciméry (excitované diméry) a exciplexy (excitované komplexy) sú excitované štruktúry, ktoré majú krátky polčas života. Vzácne plyny netvoria stabilné diméry, ale tvoria ecximéry Ar2*, Kr2* a Xe2* pri vysokom tlaku a elektrickej stimulácii.
Kovalentné diméry
[upraviť | upraviť zdroj]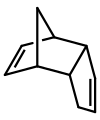

Molekulárne diméry sa často tvoria reakciou dvoch identických zlúčenín, teda 2A → A-A. Diaminokarbén dimerizuje za tvorby tetraaminoetylénu:
- 2 C(NR2)2 → (R2N)2C=C(NR2)2
Karbény sú veľmi reaktívne a ľahko tvoria nové väzby.
Dicyklopentadién je asymetrický dimér tvorený dvoma molekulami cyklopentadiénu, ktorý vzniká Diels-Alderovou reakciou. Zahriatím sa rokladá naspäť na identické monoméry.
- C10H12 → 2 C5H6
Mnoho nekovových prvkov existuje vo forme dimérov: vodík, dusík, kyslík a halogény. Vzácn plyny tvoria diméry spojené van der Waalsovými väzbami, napríklad dihélium a diargón. Označujú sa ako homonukleárne diatómové molekuly. Z kovových prvkov tvorí ortuť dimérne ióny (Hg22+), iné kovy tvoria diméry len vo výparoch. Medzi známe diméry patria Li2, Na2, K2, Rb2 and Cs2.
Mnohé malé organické molekuly takisto tvoria diméry. Jedným z hlavných je formaldehyd, ktorý tvorí dioxetán.
Chémia polymérov
[upraviť | upraviť zdroj]V kontexte polymérov slovo dimér označuje stupeň polymerizácie 2, bez ohľadu na stechiometriu alebo kondenzačné reakcie.
To platí napríklad pre disacharidy. Celobióza je dimér glukózy, aj keď touto reakciou vzniká voda:
- 2 C6H12O6 → C12H22O11 + H2O
Dimér má však inú stechiometriu, než pár monomérov (práve kvôli štiepenej vode).
Biochemické diméry
[upraviť | upraviť zdroj]Diméry pyrimidínov sa tvoria fotochemickou reakciou z pyrimidínových báz DNA, zvyčajne tymínu. Spojením báz vznikajú mutácie DNA, ktoré môžu byť karcinogénne a spôsobovať rakovinu kože.
Aminokyseliny takisto tvoria diméry, ktoré sa nazývajú dipeptidy. Príkladom je gylcylglycín pozostávajúci z dvoch molekúl glycínu spojených peptidovou väzbou. Ďalšími príkladmi sú aspartám alebo karnozín.
Referencie
[upraviť | upraviť zdroj]- ↑ CHEMISTRY (IUPAC), The International Union of Pure and Applied. IUPAC - dimerization (D01744) [online]. goldbook.iupac.org, [cit. 2021-12-23]. DOI: 10.1351/goldbook.D01744. Dostupné online.
- ↑ Bjerrum pairs in ionic solutions: A Poisson-Boltzmann approach. The Journal of Chemical Physics, 2017-05-17, s. 194904. ISSN 0021-9606. DOI: 10.1063/1.4982885. PMID 28527430.
Pozri aj
[upraviť | upraviť zdroj]Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Dimer (chemistry) na anglickej Wikipédii.
