Glyoxál
| Glyoxál | |||||||||||||||||||
 | |||||||||||||||||||
 | |||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||
| Sumárny vzorec | OHC-CHO | ||||||||||||||||||
| Synonymá | etándiál, oxaldehyd, diformyl | ||||||||||||||||||
| Vzhľad | žltá kvapalina | ||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||
| Molekulová hmotnosť | 58,036 g/mol | ||||||||||||||||||
| Teplota topenia | 15 °C | ||||||||||||||||||
| Teplota varu | 50,4 °C [1] | ||||||||||||||||||
| Hustota | 1,27 g/cm3 | ||||||||||||||||||
| Rozpustnosť | vo vode | ||||||||||||||||||
| Teplota vzplanutia | −4 °C | ||||||||||||||||||
| Teplota vznietenia | 285 °C | ||||||||||||||||||
| |||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||
| Číslo CAS | 107-22-2 | ||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||
Glyoxál (systematický názov: etándiál) je alifatická aldehydová organická zlúčenina so vzorcom OHC-CHO. Je to najmenší dialdehyd (zlúčenina s dvoma aldehydovými skupinami).
Fyzikálne vlastnosti
[upraviť | upraviť zdroj]Pri teplote nižšej, ako 15 °C má vzhľad bielej kryštalickej látky, v kvapalnom skupenstve je žltý a v plynnom zelený. Horí fialovým plameňom.[3] Vrie pri teplote vyššej, než 50,4 °C. Molekula je planárna, medzi uhlíkmi je väzba s dĺžkou 0,147 nm, väzba C=O má dĺžku 0,120 nm a C-H 0,109 nm.[1]
Chemické vlastnosti
[upraviť | upraviť zdroj]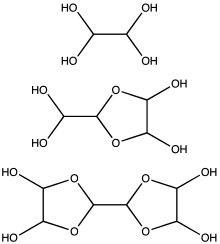
V bežne dostupnom 40 % vodnom roztoku sa vyskytuje predovšetkým v podobe troch hydratovaných foriem: monoméru, diméru a triméru (obrázok). V koncentrovanom roztoku je najčastejšou formou trimér. V zmesi s alkoholmi pri kyslej katalýze tvorí širokú škálu rôznych acetálov a poloacetálov, s primárnymi amínmi tvorí diimíny. Kontrolovanou oxidáciou vzniká najprv kyselina glyoxylová a v druhom kroku kyselina šťaveľová.[1]
Výroba
[upraviť | upraviť zdroj]Ako prvý pripravil glyoxál chemik nemecko-britského pôvodu Heinrich Debus (1824 – 1915) reakciou etanolu s kyselinou dusičnou.[4]
Komerčne je glyoxál dostupný vo forme 40 % vodného roztoku a vyrába sa dvoma priemyselnými cestami. Prvou je tzv. Laporte proces - oxidácia plynného etylénglykolu v prítomnosti katalyzátorov s obsahom medi alebo striebra. Reakcia prebieha pri teplotách 400-600 °C s výťažkami 70-80 %. Hlavným znečisťujúcim vedľajším produktom je formaldehyd, ktorého separácia je spravidla veľmi komplikovaná.[1]

Druhou je oxidácia acetaldehydu rôznymi činidlami, buďto kyselinou dusičnou (podľa Ljubowina 1942), alebo oxidom seleničitým (podľa Zumbrunna). Oxidácia s kyselinou dusičnou má výťažky maximálne 70 %, s oxidom seleničitým až 84 %.[1]
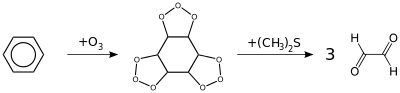
Iné spôsoby prípravy sú oxidácia eténu s atmosférickým kyslíkom na paládiovom katalyzátore, oxidáciou acetylénu alebo benzénu s ozónom za prítomnosti dimetylsulfidu (obrázok),[1] redukčnou ozonolýzou niektorých zlúčenín, napríklad hexa-1,3-diénu a podobne.[5] Tieto metódy však nie sú implementované v priemysle.[1]
Použitie
[upraviť | upraviť zdroj]V reakcii s močovinou vzniká 4,5-dihydroxy-2-imidazolidinón (DHEU), ktorý sa spolu so svojimi derivátmi (napríklad dimetylol-derivátmi - DMDHEU) tvorí základ živíc, ktoré sa používajú na hydrofóbne ošetrovanie umelých aj prírodných vláken a tkanív (obrázok).
Redukčné vlastnosti sa využívajú vo fotografickom priemysle a pri výrobe zrkadiel (redukcia kovového striebra z jeho zlúčenín).[1] Glyoxál sa tiež využíva pri syntéze niektorých heterocyklických zlúčenín (napríklad imidazolu) a pri fixácii biologických preparátov.
Bezpečnosť
[upraviť | upraviť zdroj]Glyoxál má pomerne nízku toxicitu, jeho LD50 pri orálnom podaní potkanom súc 3300 mg/kg. Môže spôsobovať alergické kožné reakcie a má podráždenie slizníc pri vdýchnutí. Je podozrivý z genetického poškodenia, pretože jeden z testov (Amesov test) na mutagenitu je s glyoxálom pozitívny.[1]
Referencie
[upraviť | upraviť zdroj]- ↑ a b c d e f g h i MATTIODA; BLANC. Ullmann’s Encyclopedia of Industrial Chemistry. [s.l.] : [s.n.], 2011. DOI:doi:10.1002/14356007.a12_491.pub2 Kapitola „Glyoxal“.
- ↑ Karta bezpečnostných údajov na carlroth.com[nefunkčný odkaz]
- ↑ Glyoxál na PubChem
- ↑ DEBUS, Heinrich. On the action of nitric acid on alcohol at common temperatures. Philosophical Magazine, 1857, roč. 4, čís. 13, s. 39-49. Dostupné online [cit. 2020-12-01].
- ↑ MEČIAROVÁ, Mária; MAGDOLEN, Peter; ZÁHRADNÍK, Pavol. Organická chémia. prvé. vyd. Bratislava : UK, 2015. ISBN 978-80-223-3850-9.
Pozri aj
[upraviť | upraviť zdroj]Iné projekty
[upraviť | upraviť zdroj] Commons ponúka multimediálne súbory na tému Glyoxál
Commons ponúka multimediálne súbory na tému Glyoxál
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článkov Glyoxal na anglickej Wikipédii a Glyoxal na českej Wikipédii.