Lakmus

Lakmus je vodou riediteľné farbivo extrahované z istých druhov lišajníkov. Používa sa ako acidobázický indikátor (indikátor pH) v chémii. Často sa ním napúšťa filtračný papier, čím vzniká lakmusový papierik alebo lakmusový papier.
História
[upraviť | upraviť zdroj]Slovo lakmus pochádza z holandského lakmoes, ktoré pochádza zo slov lēken, "kvapkať", a mōs, "listová zelenina".[1] Jeho anglický názov, litmus, pochádza zo staroseverského litmosi, "byliny používané na farbenie".[2]
Použitie lakmusu zaviedol okolo roku 1300 alchymista Arnaldus de Villanova.[3][4]
Od 16. storočia sa toto farbivo získavalo hlavne v Holandsku.[chýba zdroj]
Chemické vlastnosti
[upraviť | upraviť zdroj]
Lakmus má priradené CAS číslo 1393-92-6 a táto zmes obsahuje 10 až 15 rôznych farbív. Chemické látky prítomné v lakmuse sú pravdepodobne zhodné s látkami prítomnými v podobnej zmesi, orceíne, ale v inom pomere. Na rozdiel od orceínu majú hlavné zložky lakmusu molárnu hmotnosť okolo 3300 g/mol.[5] Acidobázické vlastnosti lakmusu sú spôsobené predovšetkým azolitmínom[6][7] alebo 7-hydroxy-2-fenoxazónovým chromofórom.[5][8] Niektoré zložky lakmusu majú konkrétne názvy, napríklad erytrolitmín (alebo erytroleín) alebo azolitmín. Azolitmín má podobné indikátorové vlastnosti.[9]
Prírodné zdroje
[upraviť | upraviť zdroj]
Lakmus sa získava z viacerých druhov lišajníkov. Hlavným zdrojom sú:
- Roccella montagnei (Mozambik)[3]
- Dendrographa leucophoea (Kalifornia)[3]
- Roccella tinctoria[7] (Azorské ostrovy, Kanárske ostrovy, západné pobrežie Južnej Ameriky)
Toto farbivo možno získať takisto z druhov:[chýba zdroj]
- Roccella fuciformis (Angola a Madagaskar)
- Roccella pygmaea (Alžírsko)
- Rocella phycopsis
- Lecanora tartarea (Nórsko, Švédsko)
- Variolaria dealbata (Pyreneje a Auvergne)
- Ochrolechia parella
- Parmotrema tinctorum
- druhy rodu Parmelia
Použitie
[upraviť | upraviť zdroj]| Lakmus (indikátor) | ||
| pod pH 4,5 | nad pH 8,3 | |
| 4,5 | ↔ | 8,3 |
Lakmus je možné pripraviť ako vodný roztok, ktorý reaguje na zmenu pH roztoku. V kyslých podmienkach je roztok červený, v zásaditých podmienkach má modrú farbu.[6]
Lakmus sa niekedy používa na farbenie vína (kyselina vínna prítomná vo víne ho sfarbuje do červena).[10]
Lakmusový papierik
[upraviť | upraviť zdroj]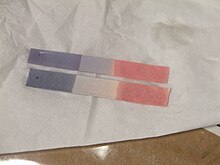
Lakmusom sa napúšťajú prúžky filtračného papiera, čím vzniká jeden z najstarších pH indikátorov, používaných na testovanie kyslosti. Tento papier je známy ako lakmusový papier či papierik. Modrý lakmusový papierik sa farbí načerveno v kyslých prostrediach a červený lakmus sa sfarbí namodro v zasaditých podmienkach. Zmena farby prebieha v rozmedzí 4,5 - 8,3 pH (pri 25 °C). Neutrálny lakmusový papierik má fialovú farbu.[3]
Modrý lakmusový papier sa pripravuje priamym namáčaním papiera v lakmusovom odvare. Červený lakmus vznikne zmiešaním veľmi zriedenej kyseliny do pôvodného modrého lakmusového roztoku (väčšinou sa používa kyselina octová alebo chlorovodíková). Lakmus je možné aj zneutralizovať pridaním menšieho množstva kyseliny, čím vznikne purpurový lakmus.[chýba zdroj]
Vlhký lakmusový papierik je možné použiť na skúšky s plynmi rozpustnými vo vode, ktoré menia kyslosť či zásaditosť roztoku. Plyn sa rozpustí vo vode a výsledný roztok zmení farbu lakmusového papieriku. Napríklad plynný amoniak, ktorý je zásaditý, sfarbí lakmusový papierik namodro.
Lakmusový papierik reaguje i na chemické reakcie iné než acidobázické. Plynný chlór ho napríklad odfarbí do biela,[11] pretože vzniká chlórnan, ktorý funguje ako bielidlo. Adíciou chlórnanu na farbivo vzniká halohydrín, čím dochádza k strate konjugovaného systému a teda i farby.[chýba zdroj] Táto reakcia je nevratná, lakmus v tomto prípade nefunguje ako indikátor.
Referencie
[upraviť | upraviť zdroj]- ↑ Definition of LACMUS [online]. www.merriam-webster.com, [cit. 2022-09-22]. Dostupné online. (po anglicky)
- ↑ Definition of LITMUS [online]. www.merriam-webster.com, [cit. 2022-09-22]. Dostupné online. (po anglicky)
- ↑ a b c d Römpp-Lexikon Chemie / 4 M - Pk.. Stuttgart : Thieme, 1998. (10., völlig überarb. Aufl.) Dostupné online. ISBN 3-13-734910-9.
- ↑ SURBER, Christian; HUMBERT, Philippe; ABELS, Christoph. pH of the Skin: Issues and Challenges. [s.l.] : Karger Medical and Scientific Publishers. Dostupné online. ISBN 9783318063851. The Acid Mantle: A Myth or an Essential Part of Skin Health?, s. 3.
- ↑ a b Beecken, H.; E-M. Gottschalk; U. v Gizycki. Orcein and Litmus. Biotechnic & Histochemistry, 2003, s. 289–302. DOI: 10.1080/10520290410001671362. PMID 15473576.
- ↑ a b „lakmus“, Malá československá encyklopedie, III., I – L, Praha: Academia, 1986, str. 708
- ↑ a b lakmus. In: Masarykův slovník naučný V, S. 302
- ↑ H. Musso, C. Rathjen. Orcein dyes. X. Light absorption and chromophore of litmus. Chem. Ber., 1959, s. 751–3. DOI: 10.1002/cber.19590920331.
- ↑ E.T. Wolf: Vollständige Übersicht der Elementar-analytischen Untersuchungen organischer Substanzen, S.450-453, veröffentlicht 1846, Verlag E. Anton (Germany)
- ↑ „lakmus“, Ottův slovník naučný, XV., Praha, 1900, str. 571, https://archive.org/details/ottvslovnknauni28ottogoog/page/571/mode/1up?view=theater
- ↑ Tests for gases - Metals and non-metals - Eduqas - GCSE Chemistry (Single Science) Revision - Eduqas [online]. BBC Bitesize, [cit. 2022-09-22]. Dostupné online. (po anglicky)
Pozri aj
[upraviť | upraviť zdroj]Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Litmus na anglickej Wikipédii.
 Wikislovník ponúka heslo Lakmus
Wikislovník ponúka heslo Lakmus
