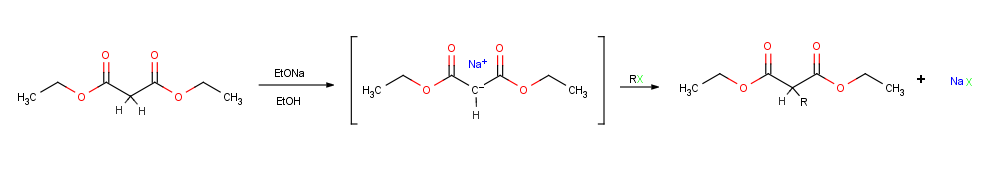
Substitúcia na alfa-uhlíku
Alfa-substitučné reakcie sú chemické reakcie, ktoré prebiehajú na prvom uhlíku od karbonylovej skupiny, na takzvanom α-uhlíku. Pritom sa α-vodík (vodík na α-uhlíku) substituuje elektrofilom. Mechanizmus prebieha buď cez enol alebo enolátový ión.

Mechanizmus alfa-substitúcie
[upraviť | upraviť zdroj]Pretože ich dvojité väzby sú bohaté na elektróny, správajú sa ako nukleofily a reagujú s elektrofilmi veľmi podobne ako alkény. No kvôli rezonancii s voľným elektrónovým párom na kyslíku sú enoly viac reaktívne ako alkény. Na nasledovnom zobrazení vinylalkoholu (H2C=CHOH) je možné všimnúť si, že na α-uhlíku je vysoká elektrónová hustota.
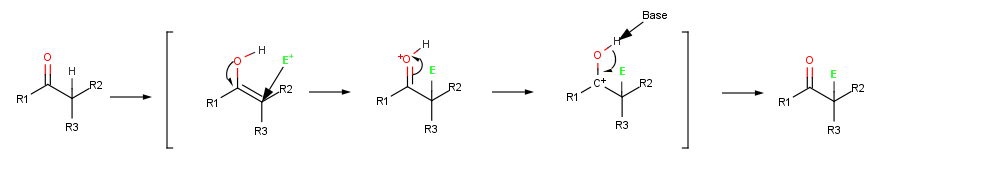
Keď alkén reaguje s elektrofilom ako je napr. HCl, prvotná adícia H + poskytuje prechodný katión ako medziprodukt a následná rýchla reakcia s Cl - poskytne produkt adície. Pri reakcii enolu s elektrofilom je rovnaký iba prvý krok. V druhom kroku namiesto reakcie s CI - kationový medziprodukt stráca protón z OH - , aby mohla vzniknúť α-substituovaná karbonylová zlúčenina.
Alfa halogenácia aldehydov a ketónov
[upraviť | upraviť zdroj]Najbežnejšie α-substitučné reakcie v laboratóriu sú halogenácie aldehydov a ketónov na ich α-pozíciách, reakciou s Cl 2 , Br 2 alebo I 2 v kyslom prostredí. Často sa využíva bróm rozpustený v kyseline octovej.
Pozoruhodné je, že halogenácie ketónov tiež prebiehajú v biologických systémoch, a to najmä v morských riasach, kde sa našli dibromoacetaldehydy, bromoacetón, 1, l, l-tribromoacetón, a ďalšie súvisiace zlúčeniny.
Halogenácia je typická α-substitučná reakcia, ktorá prebieha kyslou katalýzou za vzniku enolu ako medziproduktu.
Kyslosť Alfa Vodíka: Vytvorenie Enolátu
[upraviť | upraviť zdroj]Vodík na α-pozícii na karbonylovej zlúčenine je slabo kyslý a môže byť vytrhnutý silnou bázou za vzniku enolátu. Pre porovnanie, acetón (pKa= 19.3) a etán (pKa= 60), kde je možné si všimnút, že prítomnosť karbonylovej skupine zapríčiňuje rozdiel v kyslosti.
Vytrhnutie protónu z karbonylovej zlúčeniny nastane, keď sa väzba C-H natočí zhruba rovnobežne s p orbitálom na karbonylovej skupine. α-uhlík enolátu je v sp2-hybridizácii a má p orbitály prekrývajúce susedné karbonylové p orbitály. Kvôli tomu majú spolu s elektronegatívnejším atómom kyslíka spoločne záporný náboj a enolátový ión sa stabilizuje rezonanciou.
Karbonylové zlúčeniny sú kyslejšie než alkány z rovnakého dôvodu, prečo karboxylové kyseliny sú kyslejšie ako alkoholy. V oboch prípadoch sú anióny stabilizované rezonanciou. Enoláty sa odlišujú od karboxylátových aniónov v ich nerovnomernej rezonancii dvoch foriem - forma s negatívnym nábojom na kyslíku má menšiu energiu ako s nábojom na uhlíku. Každopádne, príncip stabilizácie rezonanciou je rovnaký v oboch prípadoch.
Kvôli nízkej kyslosti karbonylových zlúčenín pri tvorení enolátu potrebujeme silnú bázu. Pokiaľ použijeme alkoholát, napríklad etanolát sodný ako bázu, deprotonácia sa udeje iba v 0.1% substrátu, pretože acetón je slabšia kyselina ako etanol (pKa= 16). Pokiaľ však zoberieme silnejší hydrid sodný (NaH) alebo lítium diizopropylamín (LDA),celé množstvo karbonylovej zlúčeniny môže zreagovať na enolát. LDA, ktoré vieme jednoducho pripraviť reakciou silnej bázi butyllítia s diizopropylamínom, je často používaná v laboratóriu ako báza na prípravu enolátov karbonylových zlúčenín.
Veľa typov karbonylových zlúčenín, zahŕňajúc aldehydy, ketóny, estery, tioestery, karboxylové kyseliny, a amidy, sa dá previesť na enoláty reakciou s nenukleofilnou bázou LDA. Treba poznamenať, že nitrily sú tiež kyslé a môžu byť prevedené na anióny podobné enolátom. Pokiaľ je atóm vodíka obklopený dvomi karbonylovými skupinami, jeho kyslosť sa ešte zvýší. Zvýšená kyslosť β-dikarbonylových zlúčenín je zapríčinená stabilizáciou enolátov delokalizáciou negatívneho náboja medzi dvoma karbonylovými skupinami.
Reaktivita Enolátu
[upraviť | upraviť zdroj]Enoláty sú užitočnejšie ako enoly z dvoch dôvodov. Za prvé, enoly sa normálne nedajú izolovať, pretože vznikajú len ako krátko existujúce medziprodukty v nízkej koncentrácii. Naproti tomu, stabilné enoláty z roztoku sa dajú ľahko pripraviť z väčšiny karbonylových zlúčenín reakciou so silnou bázou. Za druhé, enoláty sú viac reaktívne ako enoly a poskytujú mnoho reakcií, ktoré enoly nedávajú. Kvôli tomu, že enoly sú neutrálne a enoláty záporne nabité, sú tiež oveľa lepšie nukleofily. Preto sa enoláty častejšie vyskytujú než enoly v biologickom či chémickom laboratóriu.
Vzhľadom na ich rezonanciu dvoch nerovnovážnych foriem, sa môžeme na enoláty pozerať buď ako na vinyl alkoholáty (C = C-O - ), alebo ako na α-ketokarbanióny ( - C-C = o). Preto enoláty môžu reagovať s elektrofilmi buď na svojom kyslíku alebo uhlíku. Reakcia na kyslíku vedie k derivátom enolov, kým reakcia na uhlíku vedie k α-substituovaným karbonylovým zlúčeninám. Oba typy reaktivity sú známe, ale reakcie na uhlíku sú častejšie.
Alkylácia Enolátov
[upraviť | upraviť zdroj]Snáď najdôležitejšou reakciou enolátov je ich alkylácia pomocou alkyl halogenidov či tozylátov, čím sa vytvorí nová väzba C-C a spojenie dvoch menších molekúl do jednej väčšej molekuly. Alkylácia nastane, keď nukleofilný enolát reaguje s elektrofilným alkyl halogenidom SN 2 reakciou vytláčajúc odchádzajúcu skupinu atakom zo zadnej strany.
Na alkylačné reakcie sa vzťahujú rovnaké obmedzenia, ktoré ovplyvňujú všetky SN 2 reakcie. Kvôli tomu odchádzajúcou skupinou X v alkylačnom činidle RX môže byť chlorid, bromid, Jodid, alebo tozylát. Zostávajúca skupina R alkylu by mala byť primárna , alebo tiež allylová či benzylová. Sekundárny halogenidy reagujú zle, a terciárne halogenidy nereagujú vôbec, pretože konkurenčné E2 eliminácia HX nastane okamžite. Vinylové a arylové halidy sú tiež nereaktívne, pretože prístup zo zadnej strany je sféricky bránený.
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Carbonyl_Alpha-Substitution_Reactions na anglickej Wikipédii.