Trombín
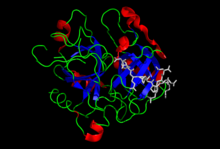
Trombín alebo Faktor IIa (FIIa) je enzým zo skupiny serínových proteáz, ktorý hrá kľúčovú úlohu v procese zrážania krvi (hemokoagulácie). Jeho najdôležitejšou úlohou v tomto procese je štiepiť fibrinogén a tým ho zmeniť z tekutej formy na vláknitú formu nazývanú fibrín. Trombín tiež aktivuje faktor VIII, ktorý tento vláknitý fibrín pospája do siete zachytávajúcej krvné telieska a tým zastavujúcej krvácanie. Okrem toho trombín plní ešte množstvo ďalších, sčasti pravdepodobne aj nepreskúmaných úloh a jeho účinky môžu byť v závislosti od podmienok tak koagulačné, ako aj antikoagulačné (protizrážanlivé).
Trombín patrí do chymotrypsínovej rodiny, čo je veľká skupina enzýmov, ktorá zahŕňa enzýmy zúčastňujúce sa procesov trávenia, krvnej koagulácie, bunkami sprostredkovanej imunity a bunkovej smrti, fibrinolýzy (rozkladu fibrínu), oplodnenia a embryonálneho vývoja. Do spustenia procesu hemokoagulácie sa v krvi nachádza v neaktívnej forme, ako tzv. protrombín, aby nedochádzalo k tvorbe krvných zrazenín vo vnútri ciev a k ich upchávaniu. Protrombín na aktívnu formu premení štiepenie vykonané komplexom formujúcim sa v procese hemokoagulácie, tzv. protrombokinázovým komplexom.
V aktívnej forme trombín pozostáva z dvojice polypeptidových reťazcov: ľahkého (A) s dĺžkou 36 aminokyselinových zvyškov a ťažkého (B) reťazca s dĺžkou 259 aminokyselinových zvyškov. Tieto reťazce sú spojené disulfidickými väzbami, čo je druh chemickej väzby tvoriacej sa medzi zvyškami dvoch aminokyselín cysteín. Aktivovaný trombín štiepi každý polypeptidový reťazec s poradím aminokyselín Leu-Val-Pro-Arg-Gly-Ser medzi zvyškami aminokyselín arginín a glycín. Táto vlastnosť mu okrem už uvedeného štiepenia fibrinogénu a aktivácie faktora VIII umožňuje aktivovať koagulačné faktory V, VII, XI a XIII; fibrinolytický inhibítor (TAFI) a proteázovo aktivované receptory PAR1 a PAR4. Efektívnosť týchto reakcií zvýši väzba sodíkového iónu (Na+) na špecifické, Na-väzobné miesto v trombíne. Celkove trombín štiepi dvanásť rôznych substrátov za asistencie piatich kofaktorov.
Trombín, tak ako aj ostatné koagulačné faktory, v krvi cirkuluje v inaktívnej forme ako protrombín. V ľudskej krvi má protrombín koncentráciu 100 μg/ml až 150 μg/ml[1] a polčas jeho rozpadu je 72 hodín.[2] Nedostatočné množstvo trombínu v krvi vedie k nekontrolovateľnému krvácaniu, nadmerné množstvo trombínu spôsobuje trombózu.[3] Preto je trombín využívaný tiež v chirurgii ako prostriedok na kontrolu krvácania pri chirurgických zákrokoch.
Protrombín sa tvorí v pečeni, ktorá je tiež hlavným miestom vzniku ďalších koagulačných faktorov.[4]
Úloha v organizme
Koagulačná kaskáda je séria chemických reakcií, ktorej sa okrem trombínu zúčastňuje viacero serínových proteáz. Serínové proteázy sú enzýmy, ktoré sú schopné štiepiť proteínové reťazce a túto vlastnosť im dodáva zvyšok aminokyseliny serín nadviazanej v ich aktívnom mieste. V koagulačnej kaskáde sú aktivované proenzýmy (neaktívne formy enzýmov) serínových proteáz a partneri potrební pre ich správnu funkciu – pro-kofaktory. Tieto pro-kofaktory majú na sebe nadviazané sacharidové (cukorné) zložky, preto ich nazývame glykoproteíny. Aktivácia serínových proteáz a kofaktorov slúži na to, aby mohli spustiť ďalší stupeň kaskády. Aktivované faktory sa označujú malým písmenkom "a". Výsledkom týchto procesov je vytvorenie fibrínovej siete, ktorá zachytí krvné telieska a tým zastaví krvácanie. Trombín má v tomto procese rôznorodé účinky, ktoré sú tak koagulačné, ako aj antikoagulačné. Štiepi štyri väzby na inaktívnom plazmatickom proteíne fibrinogéne, čím ho premení na aktívny fibrín. Ďalej stabilizuje sieť fibrínových vlákien aktiváciou fibrínového krížového stabilizátora (faktor XIII), inhibuje rozpad (lýzu) fibrínu aktivovaním faktora TAFI, stimuluje agregáciu krvných doštičiek a aktivuje faktory V, VIII, XI, a XII I, ktoré sa takisto podieľajú na hemokoagulácii.[5]
Spomenuté funkcie možno u trombínu označiť za základné. Okrem toho hrá trombín úlohu v regulácii aktivity proteínu C, ktorý sa zúčastňuje antikoagulácie, pretože je inhibítorom faktorov VIII a V. Antikoagulačná funkcia trombínu je pod kontrolou kofaktora trombomodulínu.[4] Trombín ďalej štiepi osteopontín, ktorý reguluje chronické zápalové a cievne ochorenia,[6] spúšťa chemotaxiu monocytov, je schopný podporovať migráciu buniek cez extracelulárnu matrix, čo má význam pri embryogenéze a metastáze tumorov, a má adhezívne schopnosti v závislosti od jeho RGD sekvencie.[7]
Koagulačná kaskáda hemostázy sa rozdeľuje na dve cesty: jedna je aktivovaná kontaktom (vnútorná cesta) a druhá tkanivovým faktorom (vonkajšia cesta). Obe vedú k tvorbe fibrínu. Primárna cesta spustenia koagulácie je cesta tkanivového faktora. Regulácia aktivity trombínu je veľmi dôležitá pre stálosť prostredia v krvi a ako prevencia pred trombózou, čiže patologickou tvorbou krvných zrazenín.[8] V procese kaskády, ktorá začína uvoľnením tkanivového faktora (FIII alebo TF) z poškodenej cievy, sa na FIII naviaže na faktor VII, prokonvertín, ktorý následne aktivuje.[9] Tým vznikne komplex dvoch enzýmov (TF-FVIIa), ktorý v prítomnosti vápenatých iónov rozštiepi malé množstvá faktoru X na faktor Xa, čiže na jeho aktívnu formu.[10] Ten, opäť len v prítomnosti vápenatých iónov a súčasne aj fosfolipidov, zabezpečí hromadnú premenu protrombínu (FII) na trombín (FIIa). FXa v spojení s kofaktorom FVa, vápenatými iónmi a fosfolipidmi sa označujú ako protrombinázový komplex.[11] Vápnik slúži na to, aby naviazal komplex cez koncové gama-karboxylové zvyšky, ktoré obsahujú FXa a FIXa, na fosfolipidový povrch doštičiek a prokoagulačných mikročastíc (mikrovezikúl), ktoré sa od nich oddeľujú. Samotný faktor Xa bez prítomnosti zvyšku protrombokinázového komplexu rozštiepi iba väzbu medzi aminokyselinami Arg-1 a Thr1, čím z pôvodného protrombínu odštiepi jednoreťazcový prekurzor trombínu označovaný ako pretrombín-2. Len v prítomnosti faktora Va, vápnika a fosfolipidov vykoná faktor Xa aj druhé štiepenie medzi aminokyselinami Arg49-Ile50, čím protrombín zmení na trombín.
Trombín zabezpečí svoju pozitívnu spätnú reguláciu tým, že aktivuje trombocyty, ktoré viažu cirkulujúci komplex FIII-FVIIa a ten je schopný ďalej aktivovať faktor FX, ktorý aktivuje ďalší trombín.[12] Komplex FIII-FVIIa okrem toho aktivuje aj FIXa, ktorý po stretnutí s kofaktorom VIIIa iniciuje ďalšiu tvorbu FXa, čím uzatvára cyklus.[13] Cesta kontaktnej, respektíve vnútornej aktivácie začína kontaktom krvi s kolagénom v poškodenej stene cievy. Na kolagéne vzniká primárny komplex medzi HMWK (kininogén s vysokou molekulárnou hmotnosťou), prekallikreínom a FXII. Prekallikreín sa premieňa na kallikreín a aktivuje sa FXII, ktorý následne aktivuje FXI. FXIa aktivuje FIX, ktorý so svojím kofaktorom FVIIIa tvorí tenázový komplex a ten premení FX na FXa. Cesta kontaktnej aktivácie v spúšťaní krvného zrážania je druhotná, čo sa prejavuje tým, že pacienti s veľkým nedostatkom FXII, HMWK a prekallikreínu nemajú zvýšenú krvácavosť. V obidvoch prípadoch, pri aktivácii kontaktnou cestou aj pri aktivácii cestou tkanivového faktora, je koagulačná kaskáda udržiavaná v protrombotickom stave priebežnou aktiváciou FVIII a FIX, ktoré tvoria tenázový komplex, kým nie sú potlačené antikoagulačnými cestami. Vitamín K je nenahraditeľný kofaktor pečeňovej gama-glutamylkarboxylázy, ktorý pridáva karboxylovú skupinu zvyškom kyseliny glutámovej na faktoroch II, VII, IX a X a tiež na proteíne S, proteíne C a proteíne Z.
Špecificita trombínu je primárne regulovaná väzbou na trombomodulín (kofaktor TM) a prítomnosťou sodíkových iónov.[8].[4] Trombomodulín, ktorý sa nachádza na povrchu endoteliálnych buniek, mení koagulačné účinky trombínu na antikoagulačné a to tým, že zvýši jeho substrátovú špecificitu na proteín C. Proteín C po svojej aktivácii hydrolyzuje FVa a FVIIIa, čím zastaví tvorbu trombínu. Táto komplexná sieť trombínových aktivít je koordinovaná cez exosites na povrchu trombínu. Okrem toho trombomodulín inhibuje schopnosť trombínu zrážať fibrinogén a aktivovať FV.[14] V krvnej plazme je aktivita trombínu inhibovaná jeho väzbou na antagonistu antitrombín III, ktorý zahŕňa viac než 80 % trombínových antagonistov. Antitrombín III a heparínový kofaktor II sú tiež inhibítory serínových proteáz, a preto regulujú aktivitu trombínu[15][16] K inhibícii trombínu vedie aj aktivácia proteínu C, pretože ten inhibuje faktory V a VIII a zastavuje tak tvorbu nového trombínu.[12] Aktívny trombín je odbúravaný rýchlo, aby nedošlo k nadmernej hemokoagulácii a zachovala sa priechodnosť ciev.
Dôležité efekty vyvolané trombínom sú tiež regulácia proteázovo-aktivovaných receptorov (PARs),[17] ktoré patria do superrodiny transmembránových G-proteín viažúcich receptorov.[18] U štyroch PARs označených ako PAR1 až PAR4 bol identifikovaný mechanizmus aktivácie prostredníctvom trombínu a ďalších proteáz. Medzi ne patrí PAR1, ktorý je pri nízkej koncentrácii trombínu zodpovedný za aktiváciu a agregáciu ľudských trombocytov. Pri vysokých koncentráciách enzýmu je jeho aktivita posilnená PAR4.[17]
Znefunkčnenie génu protrombínu u myší spôsobuje ich úmrtie v embryonálnej fáze alebo krátko po narodení[19][20], čo sa ale nedeje, pokiaľ majú myši inaktívny gén pre trombínové receptory v krvných doštičkách[17] alebo fibrinogéne.[21] To naznačuje , že trombín môže mať ďalšie dôležité, ale ešte neodhalené funkcie.
Stavba trombínu
Trombín vo svojej aktívnej forme pozostáva z dvoch reťazcov: A (ľahkého) a B (ťažkého). Tie sú spojené disulfidickými väzbami na pozíciách C1 a C122.[22][23] A-reťazec ľudského trombínu pozostáva z 36 aminokyselinových zvyškov, B-reťazec z 259 aminokyselinových zvyškov.[5] Sú známe aj násobné formy trombínu – alfa, beta a gama trombín. Beta a gama formy však majú oveľa nižšiu biologickú aktivitu voči fibrinogénu.[24] Molekulárna hmotnosť ľudského alfa-trombínu je 39 000 Da.[25] Funkčné miesto alfa-trombínu, oblasť priebehu chemickej reakcie (tzv. katalytické miesto) pozostáva z trojice aminokyselinových zvyškov a to histidínu 365, asparágovej kyseliny 419, a serínu 527, ktoré sú navzájom blízko.[2] Aminokyselinovú sekvenciu trombínu sa podarilo určiť koncom sedemdesiatych rokov minulého storočia.
Sekundárna štruktúra aktívnych foriem hemokoagulačných proteáz pozostáva z dvoch šesťramenných β-barelov, ktoré sú asymetricky postavené okolo ich katalytického miesta zloženého z troch aminokyselinových zvyškov. Dva z týchto zvyškov sa nachádzajú na N-konci β-barelu s nukleofilným serínom. Štandardná orientácia trombínu podľa[23] kladie jeho A-reťazec dozadu celej molekuly oproti čelnej hemisfére B reťazca. V tejto hemisfére sa nachádza vstup k aktívnemu miestu a k všetkým známym epitopom tohto enzýmu.[26] Pri vstupe do centrálneho, záporne nabitého aktívneho miesta, sa nachádzajú aminokyselinové zvyšky asparagín 519 a glutamín 522, ktoré sú dôležité pre špecifickosť ligandov.[27] Aktívne miesta trombínu zahŕňajú kladne nabité anión-viažúce miesto I rozoznávajúce fibrinogén, ktoré je kritické pre rozpoznanie receptora PARI a trombomodulínu a anión-viažúce miesto II, rozoznávajúce a viažúce heparín.[23][22] Trombín má niekoľko slučiek, z ktorých dve obklopujú aktívne miesta.[3] Významnou súčasťou molekuly je tiež Na+ väzobné miesto, ktoré je vložené medzi slučkou 220 a 186. V jeho blízkosti leží C-koniec A-reťazca.
Staršie štúdie viedli k záveru, že A-reťazec nie je nevyhnutný pre funkciu trombínu, avšak cielené mutácie v géne pre A-reťazec navodili ťažké krvácanie. Tieto funkčné defekty protrombínu boli pripísané poruchám prestavby a spracovania faktorom Xa.[4] Úplné odstránenie A-reťazca zrušením jeho disulfidických väzieb s B-reťazcom vedie k denaturácii B-reťazca a tým aj k strate jeho aktivity. Z toho vyplýva, že A-reťazec so svojimi špecifickými disulfudickými mostíkmi je nevyhnutný pre konformačnú stabilitu trombínu.[28] Informácie o celkovej štruktúre molekuly, hlavne o lokalizácii jednotlivých domén, motívov a potenciálnych miest pre intra- a inter-molekulárne interakcie priniesli prvé kryštalografické a röntgenové analýzy α-trombínu.[23] Na+-väzobné miesto sa podarilo identifikovať až neskôr prostredníctvom kryštalografie pri vysokej koncentrácii chloridu sodného.[29]
Vznik trombínu
Gén pre protrombín je u človeka umiestnený na 11. chromozóme a nazýva sa F2.[30] Po transkripcii a translácii z neho vnzikne jednoreťazcový glykoproteín, tzv. prepro-protrombín, s veľkosťou 579 aminokyselín s hmotnosťou 72 kDa.[31] Štruktúra protrombínu pozostáva z niekoľkých funkčných jednotiek: prepro sekvencie, Gla domény, dvoch kringle domén a proteázovej domény.[1] Odstránením Gla domény a dvoch kringle domén vznikne najmenší známy jednoreťazcový prekurzor α-trombínu, pretrombín-2. Pretrombín-2 zodpovedá oblasti medzi aminokyselinami Thr272 a Glu579 v pôvodnej aminokyselinovej sekvencii protrombínu.
Úpravy prepro-protrombínu na konečný stav začínajú už pred dokončením jeho translácie odstránením signálnej sekvencie signálnou peptidázou počas jeho transportu do endoplazmatického retikula. Tam je karboxylovaný γ-glutamyl karboxylázou, enzýmom, ktorý využíva redukovanú formu vitamínu K (vitamín K hydrochinón) ako kofaktor. Karboxylácia umožní trombínu viazať vápenaté ióny. Následne furínu podobná konvertáza odstráni propeptid a v procese glykozylácie sa k N-koncu kringle domény 1 naviažu dva oligosacharidové reťazce. Ďalší oligosacharidový reťazec sa potom naviaže v serín proteázovej doméne. Výsledkom je protrombín pripravený na sekréciu do krvi.[25] K štiepeniu protrombínu medzi aminokyselinami Arg271-Thr272 a Arg320-Ile321, ktorým vzniká aktívny trombín, dochádza v procese hemokoagulačnej kaskády a sprostredkuje ho protrombokinázový komplex.[32]
Problémy s použitím trombínu získaného z rôznych zdrojov
Trombín má uplatnenie v chirurgii ako prostriedok na kontrolu krvácania pacientov. Na tento účel môže slúžiť trombín získaný z krvnej plazmy hovädzieho dobytka alebo človeka. Licencia na výrobu prvého chirurgicky používaného trombínu bola udelená v roku 1943 a išlo o Thrombostat®, trombín izolovaný z plazmy hovädzieho dobytka. Následne získali licenciu ďalšie dva produkty tiež založené na izolácii trombínu z krvnej plazmy.[33] Bovínny (hovädzí) trombín však u pacientov vyvolával alergické a autoimunitné reakcie.[34] Tvoriace sa protilátky proti bovínnemu trombínu boli asociované so zvýšeným krvácaním a rizikom trombózy. Zvýšenú imunologickú odpoveď pacientov na bovínny trombín ukázali aj mnohé ďalšie štúdie, podľa ktorých sa protilátky proti bovínnemu trombínu vyskytli v rozsahu 20 % až 90 % všetkých pacientov, ktorým bol bovínny trombín podaný.[35][36][37][38] U pacientov to malo za následok zvýšené riziko potenciálne život ohrozujúcich koagulopatií a anafylaxií..[35][39][36][40][37] Ďalšie riziko používania bovínneho trombínu vyplýva z možného prenosu priónov, ktoré sú pôvodcami Creutzfeldtovej–Jakobovej choroby.[41] Trombín izolovaný z ľudskej plazmy zase môže byť potenciálne kontaminovaný inými krvnými faktormi alebo patogénmi. Suzuki a Sakuragawa imunologickou analýzou zistili prítomnosť imunoglobulínu G a protilátok proti vírusu hepatitídy B a HIV v jednom z troch skúmaných komerčných prípravkoch používaných v klinickej praxi na zastavenie krvácania.[42]
Ako alternatíva preto môže slúžiť ľudský trombín produkovaný rekombinantnými organizmami – rekombinantný ľudský trombín. Pretože je sekvenčne identický s prirodzene vytvoreným ľudským trombínom, je minimalizované riziko cross-reaktivity a sekvenčných koagulopatií. Zároveň je minimalizované aj riziko prenosu patogénov, keďže rekombinantný trombín nepochádza z plazmy. Štúdie Heffernanovej a kol. (2006) na makakoch ukázali, že implantácia rekombinantného ľudského trombínu je len minimálne imunogénna, bezpečná a danými jedincami dobre tolerovaná na rozdiel od jedincov, ktorým bol podávaný bovínny trombín. Ten síce v priebehu osemtýždňovej štúdie nespôsobil makakom pozorovateľné patologické prejavy, ale vo všetkých testovaných opiciach boli zistené špecifické protilátky proti bovínnemu trombínu.[12]
Dodnes jediný ľudský rekombinantný trombín komerčne dostupný ako lokálne hemostatikum je Recothrom® vyvinutý spoločnosťou ZymoGenetics (Seattle, WA). Recothrom® je produkovaný ako jednoreťazcový prekurzor pretrombín-2 CHO bunkovou líniou. CHO sú vaječníkové bunky čínskych škrečkov, ktorých procesy glykozylácie rekombinantných proteínov sa približujú ľudským. Nimi produkovaný trombín má identickú sekvenciu aminokyselín a stavbu disulfidických mostíkov ako natívny ľudský trombín.[43]
Referencie
- ↑ a b YONEMURA, H., IMAMURA, T., SOEJIMA, K., NAKAHARA, Y., MORIKAWA, W., USHIO, Y., KAMACHI, Y., NAKATAKE, H., SUGAWARA, K., NAKAGAKI, T., NOZAKI, C. 2004. Preparation of recombinant α-thrombin: high-level expression of recombinant human prethrombin-2 and its activation by recombinant ecarin. In J. Biochem. ISSN 0021-924X, 2004, roč. 135, č. 5, s. 577-582
- ↑ a b MICHELSON, A. D. Platelets. 2. vydanie. BAHOU, W. F. Hardbound: Elsevier Inc., 2007. ISBN 978-0-12-369367-9. Thrombin Receptors. s. 179-200
- ↑ a b HUNTINGTON, J. A, 2011: Thrombin plasticity. In Biochimica et Biophysica Acta. ISSN 0006-3002, 2011, s. 3-7.
- ↑ a b c d DI CERA, E. 2008. Thrombin. In Mol. Aspects. Med. ISSN 0098-2997, 2008, roč. 29, č. 4, s. 203-254
- ↑ a b HARVISON, P. J. Thrombin as an Agent. University of the Sciences in Philadelphia, Philadelphia, United States, 2008.
- ↑ SCATENA, M., LIAW, L., GIACHELLI, C. M., 2007. Osteopontin: a multifunctional molecule regulating chronic inflammation and vascular disease. In Arterioscler. Thromb. Vasc. Biol. ISSN 1049-8834, 2007, roč. 27, č. 11, s. 2302-2309
- ↑ PAPACONSTANTINOU, M. E., CARRELL, C. J., PINEDA, A. O., BOBOFCHAK, K. M., MATHEWS, F. S., FLORDELLIS, C. S., MARAGOUDAKIS, M. E., TSOPANOGLOU, N. E., DI CERA, E., 2005. Thrombin functions through its RGD sequence in a non-canonical conformation. In J. Biol. Chem. ISSN 0021-9258, 2005, roč. 280, č. 33, s. 29393–29396.
- ↑ a b JOHNSON, D. J., ADAMS, T. E., LI, W., HUNTINGTON, J. A. 2005. Crystal structure of wild-type human thrombin in the Na+-free state. In Biochem. J. ISSN 0264-6021, 2005, roč. 392, č. 1, s. 21–28
- ↑ FAIR, D. S., MACDONALD, M. J. 1987. Cooperative interaction between factor VII and cell surface-expressed tissue factor. In J. Biol. Chem. ISSN 0021-9258, 1987, roč. 262, č. 24, s. 11692–11698
- ↑ GAILANI, D., BROZE, G. J. 1991. Factor XI activation in a revised model of blood coagulation. In Science. ISSN 0036-8075, 1991, roč. 253, č. 5022, s. 909-912
- ↑ MANN, K. G., BUTENAS, S., BRUMMEL, K. 2003. The dynamics of thrombin formation. In Arterioscler. Thromb. Vasc. Biol. ISSN 1049-8834. 2003, roč. 23, s. 17–25
- ↑ a b c HEFFERNAN, J. K., PONCE, R. A., ZUCKERMAN, L. A., VOLPONE, J. P., VISICH, J., GISTE, E. E., JENKINS, N., BOSTER, D., PEDERSON, KNITTER, G. S., PALMER, T., WILLS M., EARLY, R. J. ROGGE, M. C. 2006. Preclinical safety of recombinant human thrombin. In Regulatory Toxicology and Pharmacology. 2006, s. 48–58
- ↑ HOUGIE, C., DENSON, K. W., BIGGS, R. 1967. A study of the reaction product of factor VIII and factor IX by gel filtration. In Thromb. Diath. Haemorrh. ISSN 0375-9997, 1967, roč. 18, č. 1-2, s. 211–222
- ↑ ESMON, N. L., OWEN, W. G., ESMON, C. T. 1982. Isolation of a membrane-bound cofactor for thrombin-catalyzed activation of protein C. In J. Biol. Chem. ISSN 0021-9258, 1982, roč. 257, č. 2, s. 859-864
- ↑ ROSENBERG, R. D., DAMUS, P. S. 1973. The purification and mechanism of action of human antithrombin-heparin cofactor. In J. Biol. Chem. ISSN 0021-9258, 1973, roč. 248, č. 18, s. 6490-6505
- ↑ TOLLEFSEN, D. M., MAJERUS, D. W., BLANK, M. K. 1982. Heparin cofactor II. Purification and properties of a heparin-dependent inhibitor of thrombin in human plasma. In J. Biol. Chem. ISSN 0021-9258, 1982, roč. 257, č. 5, s. 2162-2169
- ↑ a b c COUGHLIN, S. R. 2000. Thrombin signalling and protease-activated receptors. In Nature. ISSN 0028-0836, 2000, roč. 407, č. 6801, s. 258-264
- ↑ BRASS, L. F. 2003. Thrombin and platelet activation. In Chest. ISSN 0012-3692, 2003, roč. 124, č. 3, s. 18S-25S
- ↑ SUN, W. Y., WITTE, D. P., DEGEN, J. L., COLBERT, M. C., BURKART, M. C., HOLMBACK, K., XIAO, Q., BUGGE, T. H., DEGEN, S. J. 1998. Prothrombin deficiency results in embryonic and neonatal lethality in mice. In Proc. Natl. Acad. Sci USA. ISSN 1091-6490, 1998, roč. 95, s. 7597–7602
- ↑ XUE, J., WU, Q., WESTFIELD, L. A., TULEY, E. A., LU, D., ZHANG, Q., SHIM, K., ZHENG, X., SADLER, J. E., 1998. Incomplete embryonic lethality and fatal neonatal hemorrhage caused by prothrombin deficiency in mice. In Proc. Natl. Acad. Sci. USA. ISSN 1091-6490, 1998, roč. 95, s. 7603–7607
- ↑ SUH, T. T., HOLMBACK, K., JENSEN, N. J., DAUGHERTY, C. C., SMALL, K., SIMON, D. I., POTTER, S., DEGEN, J. L., 1995. Resolution of spontaneous bleeding events but failure of pregnancy in fibrinogen-deficient mice. In Genes Dev. 1995, roč. 9, s. 2020–2033
- ↑ a b BODE, W. 2006. Structure and interaction modes of thrombin. In Blood Cells Mol. Dis. ISSN 1079-9796, 2006, roč. 36, č. 2, s. 122–130
- ↑ a b c d BODE, W., TURK, D., KARSHIKOV, A. 1992. The refined 1.9-Å X-ray crystal structure of D-Phe-Pro-Arg-chloromethylketone-inhibited human α-thrombin: Structure analysis, overall structure, electrostatic properties, detailed active-site geometry, and structure-function relationships. In Protein Sci. ISSN 1469-896X, 1992, roč. 1, č. 4, s. 426-471
- ↑ BOISSEL, J. P., BONNIEC, B. F. le, RABIET, M. J., LABIE, D., ELI, J. 1984. Covalent structures of beta and gamma autolytic derivatives of human alpha-thrombin. In J. Biol. Chem. ISSN 0021-9258, 1984, roč. 259, č. 9, s. 5691-5697
- ↑ a b DAVIE, E. W., KULMAN, J. D. 2006. An overview of the structure and function of thrombin. In Semin. Thromb. Hemost. ISSN 0094-6176, 2006, roč. 32, suppl. 1, s. 3–15
- ↑ PINEDA, A. O., CARRELL, C. J., BUSH, L. A., PRASAD, S., CACCIA, S., CHEN, Z. W., MATHEWS, F. S., DI CERA, E., 2004. Molecular dissection of Na+ binding to thrombin. In J. Biol. Chem. ISSN 0021-9258, 2004, roč. 279, s. 31842 –31853
- ↑ GUINTO, E. R., VINDIGNI, A., AYALA, Y. M., DANG, Q.D., DI CERA, E. 1995. Identification of residues linked to the slow→fast transition of thrombin. In Proc. Natl. Acad. Sci. Unit. States Am. ISSN 1091-6490, 1995, roč. 92, č. 24, s. 11185-11189
- ↑ SINGH, R., CHANG, J. Y. 2003. Structural stability of human alpha-thrombin studied by disulfide reduction and scrambling. In Biochimica et biophysica acta. ISSN 0006-3002, 2003, roč. 1651, č. 1-2, s. 85-92
- ↑ DI CERA, E., GUINTO, E. R., VINDIGNI, A., DANG, Q. D., AYALA, Y. M., WUYI, M., TULINSKY, A. 1995. The Na+ binding site of thrombin. In J. Biol. Chem. ISSN 0021-9258, 1995, roč. 270, č. 38, s. 22089–22092
- ↑ Royle NJ, Irwin DM, Koschinsky ML, MacGillivray RT, Hamerton JL. Human genes encoding prothrombin and ceruloplasmin map to 11p11-q12 and 3q21-24, respectively. Somat. Cell Mol. Genet., May 1987, s. 285–92. DOI: 10.1007/BF01535211. PMID 3474786.
- ↑ JENNY, N. S., MANN, K. G., 2001. Thrombin. In: Colman, R.W., Hirsh, J., Marder, V. J., Clowes, A.W., George, J. N. (Eds.), Hemostasis and Thrombosis: Basic Principles and Clinical Practice. Lippincott Williams& Wilkins, Philadelphia, pp. 171–189
- ↑ SOEJIMA, K., MIMURA, N., YONEMURA, H., NAKATAKE, H., IMAMURA, T., NOZAKI, C. 2001. An efficient refolding method for the preparation of recombinant human prethrombin-2 and characterization of the recombinant-derived α-thrombin. In J. Biochem. ISSN 0021-924X, 2001, roč. 130, č. 2, s. 269-277.
- ↑ GERSHON, S. K., CHANG, A. C., PURVIS, W. V., SALIVE, M. 1999. Misadministration of topical bovine thrombin. In JAMA, J. Am. Med. Assoc. 282, 1999
- ↑ WAI, Y., TSUI, V., PENG, Z., RICHARDSON, R., OREOPOULOS, D., TARLO, S.M. 2003. Anaphylaxis from topical bovine thrombin (Thrombostat®) during haemodialysis and evaluation of sensitization among a dialysis population. In Clin. Exp. Allergy. ISSN 0954-7894, 2003, roč. 33, č. 12, s. 1730-1734
- ↑ a b CMOLIK, B. L., SPERO, J. A., MAGOVERN, G. J., CLARK, R. E. 1993. Redo cardiac surgery: late bleeding complications from topical thrombin-induced factor V defciency. In J. Thorac. Cardiovasc. Surg. 105, 222–227. discussion 227–228
- ↑ a b ORTEL, T. L., MERCER, M. C., THAMES, E. H., MOORE, K. D., LAWSON, J. H., 2001. Immunologic impact and clinical outcomes after surgical exposure to bovine thrombin. In Ann. Surg. ISSN 1528-1140, roč. 233, s. 88–96
- ↑ a b SANDS, J. J., NUDO, S. A., ASHFORD, R. G., MOORE, K. D., ORTEL, T. L., 2000. Antibodies to topical bovine thrombin correlate with access thrombosis. In Am. J. Kidney Dis. 2000, roč. 35, s. 796–801
- ↑ WINTERBOTTOM, N., KUO, J.M., NGUYEN, K., REICH, C. J., TRENT, K. J., RONDINONE, J. F., SHARGILL, N. S. 2002. Antigenic responses to bovine thrombin exposure during surgery: a prospective study of 309 patients. In J. Appl. Res. 2002, roč. 2, s. 1–11
- ↑ DORION, R. P., HAMATI, H. F., LANDIS, B., FREY, C., HEYDT, D., CAREY, D. 1998. Risk and clinical significance of developing antibodies induced by topical thrombin preparations. In Arch. Pathol. Lab. Med. 1998, roč. 122, s. 887–894
- ↑ POYNTON, A. R., NELSON, M. C., MCCANCE, S. E., LEVINE, R. L., O’LEARY, P. F., 2003. Bovine thrombin induces an acquired coagulopathy in sensitized patients undergoing revision spinal surgery: a report of two cases. Spine 28, E221–E223
- ↑ LLEWELYN, C. A., HEWITT, P. E., KNIGHT, R. S., AMAR, K., COUSENS, S., MACKENZIE, J., WILL, R. G., 2004. Possible transmission of variant Creutzfeldt-Jakob disease by blood transfusion. Lancet 363, 417–421
- ↑ SUZUKI, S., SAKURAGAWA, N. 1989. A study on the properties of commercial thrombin preparations. In Thromb. Res. ISSN 0049-3848, 1989, roč. 53, č. 3, s. 271-277
- ↑ BISHOP, P. D., LEWIS, K. B., SCHULTZ, J., WALKER, K. M., 2006. Comparison of recombinant human thrombin and plasma-derived human alphathrombin. In Semin. Thromb. Hemostasis, 2006, roč. 32, s. 86–97
