Lomená molekulárna geometria
| Lineárna molekulárna geometria | |
|---|---|
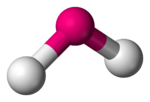 | |
| Príklady | H2O, SO2 |
| Bodová grupa | C2v |
| Koordinačné číslo | 2 |
| Väzbový uhol | 90°<θ<120° |
| Polarita | >0 |
Molekuly s dvoma väzbami vedľa seba, ktoré nie sú v lineárnom usporiadaní, majú lomenú molekulárnu geometriu. Niektoré atómy, napríklad kyslík, majú takmer vždy svoje dve (alebo viac) kovalentné väzby v nelineárnom usporiadaní kvôli ich elektrónovej konfigurácii. Voda (H2O) je príkladom lomenej molekuly,[1] ako aj jej analógy. Väzbový uhol H-O-H vo vode je rovný približne 104.45°.[2] Nelineárna lomená geometria je bežná pre trojatómové molekuly a ióny, ktoré obsahujú len prvky hlavných skupín periodickej tabuľky (skupiny 1, 2 a 13-17). Medzi príklady patria oxid dusičitý (NO2), chlorid sírnatý (SCl2) a metylén (CH2).
Vlastnosti
[upraviť | upraviť zdroj]
Táto geometria je takmer vždy konzistená s geometriou predpovedanou podľa teórie VSEPR, ktorý zvyčajne vysvetľuje nekolinearitu väzieb kvôli prítomnosti voľného elektrónového páru. Existuje niekoľko variantov tohto ohybu, najbežnejším je AX2E2 (centrálny atóm A s dvoma substituentmi X a dvoma voľnými elektrónovými pármi E, ktoré dokončujú elektrónový oktet centrálneho atómu). Väzbový uhol sa v týchto molekulách pohybuje okolo 104 až 109,5 °, kde 109,5 ° odpovedá uhlu v tetraédri,[1] ktorý vzniká pri štyroch sp3 hybridizovaných orbitáloch. Väzbový uhol býva o niečo menší, pretože voľné elektrónové zaberajú viac miesta v priestore než kovalentné väzby, pretože viac odpodzujú väzbové elektróny.[1] Najbežnejšie skutočné uhly sú 105 °, 107 ° a 109 °, ktoré sa môžu mierne meniť kvôli rôznym vlastnostiam naviazaných atómov (X). Väzbový uhol však môže byť i výrazne menší, napríklad v molekule telánu je to približne 90 °.
V ostatných prípadoch takisto dochádza k hybridizácii orbitálov, ale v rôznej miere. Molekuly typu AX2E1, napríklad ozón O3[1] alebo SnCl2, majú len jeden voľný elektrónový pár väzbový uhol je asi 120 ° (uhol odpovedá rovnoramennému trojuholníku). Uhol je zvyčajne trochu menší, opäť kvôli prítomnosti voľného elektrónového páru, takže napríklad v ozóne je väzbový uhol asi 116 °.[1] Naopak v príklade niektorých zlúčenín je tento uhol o niečo väčší, napríklad u NO2. Dusík má totižto len jeden nepárový elektrón a nie voľný elektrónový pár, takže repulzia nie je až taká silná.[1] Tieto zlúčeniny majú tri sp2 orbitály. Takisto existujú i sd hybridizované zlúčeniny AX2, ktoré sa vyskytujú u prechodných kovov bez voľných elektrónových párov. V takom prípade je uhol približne 90 ° (pravý uhol) a takisto a geometria sa takisto označuje ako lomená.
Referencie
[upraviť | upraviť zdroj]- ↑ a b c d e f Bent Molecular Geometry [online]. chemistry.elmhurst.edu, [cit. 2022-07-26]. Dostupné online. Archivované 2021-06-15 z originálu.
- ↑ MIESSLER, G. L.; TARR, D. A.. Inorganic Chemistry. 3rd. vyd. [s.l.] : Pearson/Prentice Hall, 2004. Dostupné online. ISBN 0-13-035471-6.
Pozri aj
[upraviť | upraviť zdroj]Externé odkazy
[upraviť | upraviť zdroj]- 3D Chem: Chemistry, Structures, and 3D Molecules
- Interactive molecular examples for point groups
- Molecular Modeling
- Animated Bent Geometry
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Bent molecular geometry na anglickej Wikipédii.
