Mononuklidický prvok
- Nezamieňať s heslom monoizotopický prvok.
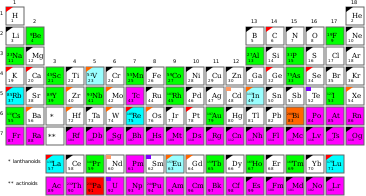
Oranžová a červená farba: Mononuklidické, ale rádioaktívne prvky (bizmut a protaktínium)
Mononuklidický prvok je taký chemický prvok, ktorý sa prirodzene nachádza na Zemi ako jediný nuklid (ktorý môže, ale nemusí byť stabilný). Tento jediný nuklid má charakteristickú atómovú hmotnosť. Prirodzený výskyt tohto prvku je potom vyhradený prakticky výlučne na tento jeden izotop, ktorý je stály alebo má dlhý polčas rozpadu. Celkom existuje 21 mononuklidických prvkov. 19 z nich patrí do prvej kategórie (ktoré sú monoizotopické a mononuklidické) a zvyšné 2 (bizmut[Pozn. 1] a protaktínium) patria do druhej kategórie (sú mononuklidické, ale nie sú monoizotopické, pretože majú nula stabilných nuklidov, nie jeden).
Existuje celkom 26 monoizotopických prvkov, ktoré majú podľa definície len jeden stabilný izotop. Z nich ale 7 nie je mononuklidických, pretože sa v prírode vyskytujú i v podobe rádioizotopov s veľmi dlhým polčasom rozpadu (primordiálnych rádionuklidov).
Zoznam mononuklidických prvkov
[upraviť | upraviť zdroj]Izotopová hmotnosť pochádza od Národného inštitútu štandardov a technológií (2005).[1]
| Prvok | Najstabilnejší nuklid | Z (p) | N (n) | Hmotnosť izotopu (Da) | Polčas rozpadu | Druhý najstabilnešjší nuklid | N (n) | Polčas rozpadu |
|---|---|---|---|---|---|---|---|---|
| Berýlium | 9Be | 4 | 5 | 9,012 182(3) | Stabilný | 10Be | 6 | 1,387(12)×106 r |
| Fluór | 19F | 9 | 10 | 18,998 403 2(5) | Stabilný | 18F | 9 | 109,739(9) min |
| Sodík | 23Na | 11 | 12 | 22,989 770(2) | Stabilný | 22Na | 11 | 2,6018(22) y |
| Hliník | 27Al | 13 | 14 | 26,981 538(2) | Stabilný | 26Al | 13 | 7,17(24)×105 r |
| Fosfor | 31P | 15 | 16 | 30,973 761(2) | Stabilný | 33P | 18 | 25,35(11) d |
| Skandium | 45Sc | 21 | 24 | 44,955 910(8) | Stabilný | 46Sc | 25 | 83,79(4) d |
| Mangán | 55Mn | 25 | 30 | 54,938 049(9) | Stabilný | 53Mn | 28 | 3,7(4)×106 r |
| Kobalt | 59Co | 27 | 32 | 58,933 200(9) | Stabilný | 60Co | 33 | 5,2713(8) r |
| Arzén | 75As | 33 | 42 | 74,921 60(2) | Stabilný | 73As | 40 | 80,30(6) d |
| Ytrium | 89Y | 39 | 50 | 88,905 85(2) | Stabilný | 88Y | 49 | 106,616(13) d |
| Niób | 93Nb | 41 | 52 | 92,906 38(2) | Stabilný | 92Nb | 51 | 3,47(24)×107 r |
| Ródium | 103Rh | 45 | 58 | 102,905 50(2) | Stabilný | 102mRh | 57 | 3,742(10) r |
| Jód | 127I | 53 | 74 | 126,904 47(3) | Stabilný | 129I | 76 | 1,57(4)×107 r |
| Cézium | 133Cs | 55 | 78 | 132,905 45(2) | Stabilný | 135Cs | 80 | 2,3×106 r |
| Prazeodým | 141Pr | 59 | 82 | 140,907 65(2) | Stabilný | 143Pr | 84 | 13,57(2) d |
| Terbium | 159Tb | 65 | 94 | 158,925 34(2) | Stabilný | 158Tb | 93 | 180(11) r |
| Holmium | 165Ho | 67 | 98 | 164,930 32(2) | Pozorovateľne stabilný | 163Ho | 97 | 4570(25) r |
| Túlium | 169Tm | 69 | 100 | 168,934 21(2) | Pozorovateľne stabilný | 171Tm | 102 | 1,92(1) r |
| Zlato | 197Au | 79 | 118 | 196,966 55(2) | Pozorovateľne stabilný | 195Au | 116 | 186,098(47) d |
| Bizmut | 209Bi | 83 | 126 | 208,980 38(2) | 2,01(8) 1019 y | 210mBi | 127 | 3,04(6)×106 r |
| Protaktínium | 231Pa | 91 | 140 | 231,035 88(2) | 3,276(11) 104 y | 233Pa | 142 | 26,975(13) d |
Použitie v metrológii
[upraviť | upraviť zdroj]Mnohé fyzikálne jednotky boli historicky alebo sú dodnes definované podľa vlastností konkrétnych látok, ktoré sa v mnohých prípadoch vyskytujú v prípade ako zmesi rôznych izotopov, napríklad:
| Jednotka | Veličina | Látka | Vlastnosť | Počet bežných izotopov | Aktuálny status (2022) |
|---|---|---|---|---|---|
| Sekunda | Čas | Cézium | Frekvencia hyperjemných prechodov | 1 | Stále sa používa ako jedna zo základných jednotiek sústavy SI[2] |
| Meter | Dĺžka | Kryptón | Vlnová dĺžka prechodu | 6 | Redefinovaná v roku 1983[3] |
| Viaceré | Teplota | Voda | Teplota varu, teplota topenia a trojný bod | 2 pre vodík a 3 pre kyslík | Redefinovaná v roku 2019[4] alebo sa nepoužíva |
| Kalória a
British thermal unit (BTU) |
Energia | Voda | Špecifická tepelná kapacita | 2 pre vodík a 3 pre kyslík | Kalória bola redefinovaná podľa joulu, BTU sa stále používa.[5] Ani jedna z týchto jednotiek nie je súčasťou SI alebo nie je odporúčané ju používať |
| Mól | Látkové množstvo | Uhlík | Atómová hmotnosť | 3 | Redefinovaná v roku 2019[6] |
| Dalton | Hmotnosť | Uhlík | Atómová hmotnosť | 3 | Stále sa používa a je akceptovaná (ale nie súčasťou) SI[7] |
| Kandela | Svietivosť | Platina | Jas pri teplote topenia | 6 | Redefinovaná v roku 1979[8] |
| Milimeter ortuti | Tlak | Ortuť | Hustota | 7 | Redefinovaná podľa pascalu, nie je súčasťou SI alebo nie je odporúčané ju používať |
Keďže vzorky pochádzajúce z rôznych prírodných zdrojov sa môžu líšiť pomerom izotopov, žiadané vlastnosti sa môžu líšiť. Ak by definície nebrali do úvahy izotopové zloženie, mohlo by dôjsť k nejasnostiam a odchýlkam v praktických meraniach jednotiek v rôznych laboratóriách, ako to bolo s kelvinom pred rokom 2007.[9] Ak definícia využíva len jeden izotop (ako je to napríklad pre Dalton) alebo konkrétny pomer izotopov (napríklad Vienna Standard Mean Ocean Water), nedochádza k nejasnostiam, ale pridáva technické obtiaže (prípravu vzoriek s daných pomerom izotopov) a nepresnosti (podľa toho, ako veľmi sa daná vzorka mení od referenčnej vzorky). Použitie mononuklidických prvkov ako referenčných materiálov umožňuje obísť oba tieto problémy a aktuálne jedinou látkou, ktorá sa využíva v aktuálnej definícii jednotiek SI (z roku 2019) je cézium, ktoré je mononuklidické.
Mononuklidické prvky sú vedecky zaujímavé i preto, že ich atómové hmotnosti možno merať veľmi presne, keďže nepresnosť spojená s pomerom izotopov v danej vzorke je minimálna. Iným spôsobom, ako povedať to isté, je, že pre tieto prvky sa štandarná atómová hmotnosť rovná atómovej hmotnosti.[10]
V praxi sa používa len 11 mononuklidických prvkov v metrológii využívajúcej štandardnú atómovú hmotnosť. Týmito prvkami sú hliník, bizmut, cézium, kobalt, zlato, mangán, fosfor, skandium, sodík, terbium a tórium.[11]
V nukleárnej magnetickej rezonancii (NMR) sú najsenzitívnejšie stabilné jadrá vodík-1 (1H), fluór-19 (19F) a fosfor-31 (31P). Fluór a fosfor sú monoizotopické a vodík je takmer monoizotopický. 1H NMR, 19F NMR a 31P NMR tak umožňujú identifikáciu a štúdium zlúčenín, ktoré obsahujú tieto prvky.[chýba zdroj]
Kontaminácia stopovým množstvom nestabilných izotopov
[upraviť | upraviť zdroj]V niektorých prírodných vzorkách môže byť prítomná stopová koncentrácia nestabilných izotopov. Napríklad berýlium-10 (10Be), ktorého polčas rozpadu je 1,4 milióna rokov, vzniká pôsobením kozmického žiarenia vo vyšších vrstvách atmosféry Zeme; jód-129 (129I), ktorého polčas rozpadu je 15,7 milióna rokov, vzniká rôznymi kozmogénnymi a nukleárnymi mechanizmami; cézium-137 (137Cs), ktorého polčas rozpadu je 30 rokov, vzniká štiepením jadier atómov. Tieto izotopy sa používajú v rôznych analytických a forenzných aplikáciách.[chýba zdroj]
Poznámky
[upraviť | upraviť zdroj]- ↑ Až do roku 2003 sa predpokladalo, že 209Bi patrí do prvej skupiny. Potom sa zistilo, že jeho polčas rozpadu je približne 1019 rokov, teda miliardukrát dlhší než je vek vesmíru. Viac pozri na stránke bizmut.
Referencie
[upraviť | upraviť zdroj]- ↑ Atomic Weights and Isotopic Compositions with Relative Atomic Masses. NIST, 2009-08-23. Dostupné online [cit. 2023-08-07]. (po anglicky)
- ↑ Second - BIPM [online]. . Dostupné online.
- ↑ Metre - BIPM [online]. . Dostupné online.
- ↑ Kelvin - BIPM [online]. . Dostupné online.
- ↑ British thermal units (Btu) - U.S. Energy Information Administration (EIA) [online]. . Dostupné online.
- ↑ Mole - BIPM [online]. . Dostupné online.
- ↑ The International System of Units (SI) [online]. [Cit. 2023-08-07]. Dostupné online. Archivované 2023-07-03 z originálu.
- ↑ Candela - BIPM [online]. . Dostupné online.
- ↑ Resolution 10 - BIPM [online]. . Dostupné online.
- ↑ N. E. Holden, "Standard Atomic Weight Values for the Mononuclidic Elements - 2001," BNL-NCS-68362, Brookhaven National Laboratory (2001)
- ↑ IUPAC list of mononuclidics for metrology purposes
Pozri aj
[upraviť | upraviť zdroj]- Primordiálny prvok
- Zoznam nuklidov
- Tabuľka nuklidov
- Izotopová geochémia
- Rádionuklid
- Zoznam prvkov podľa stability izotopov
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Mononuclidic element na anglickej Wikipédii.
