Tetrahydridoboritan sodný
| Tetrahydridoboritan sodný | |||||||||||||||||||||||
 | |||||||||||||||||||||||
 | |||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||
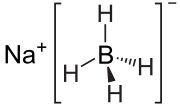
| Sumárny vzorec | NaBH4 | ||||||||||||||||||||||
| Synonymá | bórhydrid sodný, hydrid sodno-boritý | ||||||||||||||||||||||
| Vzhľad | biela kryštalická zlúčenina | ||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||
| Molárna hmotnosť | 37,83 g/mol | ||||||||||||||||||||||
| Teplota topenia | 400 °C (rozkladá sa) | ||||||||||||||||||||||
| Hustota | 1,07 g·cm-3 | ||||||||||||||||||||||
| Rozpustnosť | 55 g/100 ml (vo vode), 13 g/100 ml (v metanole), 3,16 g/ 100 ml (v etanole)[1] taktiež rozpustný aj v pyridíne, amínoch a skvapalnenom amoniaku | ||||||||||||||||||||||
| Teplota vzplanutia | 70 °C | ||||||||||||||||||||||
| Teplota vznietenia | približne 220 °C | ||||||||||||||||||||||
| Medze výbušnosti | 3% | ||||||||||||||||||||||
| |||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||
| Číslo CAS | 16940-66-2 | ||||||||||||||||||||||
| Číslo UN | 1426 | ||||||||||||||||||||||
| EINECS číslo | 241-004-4 | ||||||||||||||||||||||
| Číslo RTECS | ED3325000 | ||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||
Tetrahydridoboritan sodný (iné názvy: bórhydrid sodný, hydrid sodno-boritý) je biela kryštalická pevná anorganická zlúčenina. Je to redukovadlo, ktoré sa využíva pri chemických reakciách ako aj v laboratórnom meradle, tak aj pri priemyselnej chemickej veľkovýrobe. Rozpustný je v alkoholoch, niektorých éteroch a aj vo vode, s tou však reaguje za vzniku vodíku.[1]
Túto zlúčeninu objavil americký chemik Hermann Irving Schlesinger v 40. rokoch minulého storočia, ktorý spolu so svojím výskumným tímom skúmal prchavé zlúčeniny uránu.[2] Výsledky výskumu boli po vojne uverejnené v roku 1953.
Výroba
[upraviť | upraviť zdroj]Priemyselne sa vyrába reakciou hydridu sodného a trimetylboritanu pri rozmedzí teplôt 250 - 270 °C, pričom prebieha nasledovná reakcia:
B(OCH3)3 + 4 NaH → NaBH4 + 3 NaOCH3
Okrem toho sa dá vyrobiť aj tzv. Bayerovým spôsobom, t.j. reakciou medzi bóraxom, oxidom kremičitým, vodíkom a sodíkom. Táto reakcia prebieha podľa chemickej rovnice:
Na2B4O7 + 16 Na + 8 H2 + 7 SiO2 → 4 NaBH4 + 7 Na2SiO3
Kvôli vysokej cene sodíku existujú pokusy o nahradenie sodíka iným lacnejším, vhodným kovom ako napríklad horčík. Napriek týmto pokusom nebola však táto upravená reakcia preskúmaná natoľko, aby boli nájdené vhodné reakčné podmienky, pri ktorých je výťažok dostatočne vysoký aby bola finančne výhodná a zároveň prebehla dostatočne rýchlo. Takéto reakcie by mohli byť:[3][4]
8 MgH2 + Na2B4O7 + Na2CO3 → 4 NaBH4 + 8 MgO + CO2
A taktiež
MgH2 + NaBO2 → NaBH4 + 2 MgO
Redukčné vlastnosti
[upraviť | upraviť zdroj]Tetrahydridoboritanom sodným sa dajú reduvať mnohé karbonylové zlúčeniny. V laboratóriu sa najčastejšie používa na redukciu ketónov a aldehydov na príslušné alkoholy. Taktiež dokáže redukovať aj acylchloridy, organické anhydridy, tioestery a imíny za izbovej teploty, poprípade nižšej.
S vodou a alkoholmi reaguje za vzniku vodíku a boritanu. Reakcia s alkoholmi je však dostatočne pomalá na to aby sa dali použiť ako rozpúšťadlo.
Okrem Tetrahydridoboritanu sodného existujú aj iné, silnejšie štruktúrne podobné redukčné činidlá. Ide o látky v ktorých sú vodíky nahradené alkylovými skupinami (ako napríklad trietylbórhydrid lítny), poprípade nahradením centrálneho atómu atómom hliníku (napr. hydrid sodno-hlinitý).[5]
Reaktivita samotného bórhydridu sodného sa dá ovplyvniť rôznymi reaktantmi.[6][7] Napríklad oxidáciou jódom v tetrahydrofuráne vznikne boritanovo-tetrahydrofuránový komplex, ktorým sa dajú redukovať karboxylové kyseliny.[8]
Referencie
[upraviť | upraviť zdroj]- ↑ a b Sodium Borohydride Wiley Online Library (po anglicky)
- ↑ New Developments in the Chemistry of Diborane and the Borohydrides. I. General Summary ACS Publications (po anglicky)
- ↑ A Recycling Hydrogen Supply System of NaBH4 Based on a Facile Regeneration Process: A Review MDPI - inorganics (po anglicky)
- ↑ Review of Chemical Processes for the Synthesis of Sodium Borohydride (po anglicky)
- ↑ Reductions by the Alumino- and Borohydridesin Organic Synthesis (PDF, po anglicky)
- ↑ Methods of enhancement of reactivity and selectivity of sodium borohydride for applications in organic synthesis ScienceDirect (po anglicky)
- ↑ Recent methodologies mediated by sodium borohydride in the reduction of different classes of compounds Wiley Online Library (po anglicky)
- ↑ Selective reduction of carboxylic acids into alcohols using sodium borohydride and iodine ACS Publications (po anglicky)


