Pseudouridín
| Pseudouridín | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C9H12N2O6 |
| Synonymá | 5-[(2S,3R,4S,5R)-3,4-Dihydroxy-5-(hydroxymetyl)oxolán-2-yl]pyrimidín-2,4(1H,3H)-dión |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 244,20 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 1445-07-4 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Pseudouridín[1] (symbol Ψ)[2] je izomér nukleozidu uridínu, v ktorom je báza uracil spojená s ribózou C-C väzbou (uhlík-uhlík) namiesto zvyčajnej N-C glykozidovej väzby (dusík-uhlík).
V bunkovej RNA je pseudouridín najbežnejšou modifikáciou RNA.[3] Po transkripcii a syntéze môže byť RNA modifikovaná viac ako 100 rôznymi chemickými úpravami.[3] Tie môžu post-transkripčne ovplyvniť expresiu RNA a môžu plniť rôzne úlohy v bunke vrátane translácie, lokalizácie a stabilizácie RNA. Väzba uhlík-uhlík prítomná v pseudouridíne medzi uracilom a ribózou umožňuje väčšiu rotačnú voľnosť a konformačnú flexibilitu.[4] Okrem toho môže pseudouridín tvoriť o jednu vodíkovú väzbu viac na N1 pozícii.
Pseudouridín je bežný, ale záhadný štrukturálny komponent rôznych molekúl RNA (transferovej, ribozómovej, malej nukleárnej a malej nukleolárnej RNA). Nedávno bol pseudouridín objavený i v kódujúcej RNA.[5] Keďže je to najbežnejšia modifikácia RNA, nachádza sa vo všetkých troch doménach života a bola prvou objavenou modifikáciou. Zastupuje asi 4 % nukleotidov v tRNA kvasiniek.[chýba zdroj] Táto modifikácia stabilizuje RNA a zlepšuje skladanie báz vďaka tvorbe dodatočnej vodíkovej väzby s vodou, ktorú tvorí pomocou voľnej imino skupiny na N1.[6] V rRNA Escherichia coli sa nachádza 11 pseudouridínov, v cytoplazmovej rRNA kvasiniek je ich 30, v mitochondriálnej 21S rRNA je jediná takáto úprava a v ľudskej rRNA je prítomných asi 100 pseudouridínov.[chýba zdroj]
Bolo preukázané, že pseudouridín v rRNA a tRNA môže doladiť a stabilizovať regionálne štruktúrne motívy a pomôcť udržať funkcie počas dekódovania mRNA, skladania ribozómov a translácie.[4][7][8] Pseudouridín v snRNA zlepšuje RNA-pre-mRNA interakciu v spliceozóme, čím sa umožňuje regulácia zostrihu.[9]
Efekty a modifikácia rôznych tRNA
[upraviť | upraviť zdroj]tRNA
[upraviť | upraviť zdroj]
Ψ je všadeprítomný v tomto druhu RNA a umožňuje bežné štruktúrne motívy tRNA. Jeden takýto motív je TΨC, ktorý obsahuje Ψ55. Ψ sa bežne nachádza v D-ramene a antikodónovom ramene a slučke tRNA v každej doméne života. V každom štruktúrnom motíve stabilizujú unikátne fyzikálne chemické vlastnosti pseudouridínu štruktúru tRNA, čo by nebolo možné so štandardným uracilom.[4]
Pseudouridín počas translácie moduluje interakciu tRNA s molekulami rRNA a mRNA. Ψ a ostatné modifikované nukleotidy ovplyvňujú lokálnu štruktúru domén tRNA, v ktorých sa nachádzajú, bez toho, aby ovplvynili celkový tvar RNA. Pseudouridín sa zdá byť kritický antikodónovej slučke pre správne viazanie tRNA na ribozóm. Ψ stabilizuje dynamickú štruktúru tohto regiónu a zlepšuje silné viazanie na 30S podjednotku ribozómu. Stabilizovaná konformácia andikodónovej slučky pomáha udržať správne párovanie kodón-antikodón počas translácie. Táto stabilita môže zlepšiť presnosť translácie, pretože sa znižuje rýchlosť tvorby peptidovej väzby, čo znamená, že ribozóm môže odmietnuť nesprávne páry kodón-antikodón. Napriek dôležitej úlohe Ψ v stabilizácii lokálnych štruktúr nie je jeho prítomnosť nutná pre životnosť bunky a takisto zvyčajne nie je nutná pre aminoacyláciu (naviazanie aminokyseliny na tRNA).[4]
mRNA
[upraviť | upraviť zdroj]Pseudouridín sa nachádza v mRNA, ktoré fungujú ako predloha pre syntézu bielkovín. Ψ v mRNA môže ovplyvniť špecificitu stop kodónov (UAA, UGA a UAG). V týchto stop kodónoch dochádza k potlačeniu nezmyselných mutácii práve vďaka modifikácii U→Ψ a mutácii U→C.[10] Vo vakcíne na SARS-CoV-2 od BioNTech/Pfizer, známej ako BNT162b2 alebo Comirnaty, sú všetky uridíny nahradené za N1-metylpseudouridín,[11] teda nukleozid podobný pseudouridínu, ktorý obsahuje metylovú skupinu na N1 atóme.
rRNA
[upraviť | upraviť zdroj]Pseudouridín sa nachádza i vo veľkej a malej podjednotke ribozómu vo všetkých doménach života a ich organelách. Ψ je prítomný hlavne v doménach II, IV a V a stabilizuje interakcie RNA-RNA a/alebo RNA-bielkovina. Táto stabilita sprostredkovaná pseudouridínom môže napomáhať skladaniu rRNA a ribozómov. Pseudouridín môže takisto ovplyvniť stabilitu lokálnych štruktúr, ktoré ovplyvňujú rýchlosť a presnosť dekódovania a opravovania počas translácie.[4]
snRNA
[upraviť | upraviť zdroj]Pseudouridín sa nachádza v snRNA hlavných spliceozómov eukaryotov. Prítomnosť Ψ je často fylogeneticky zachovávaná, ale naprieč rôznymi taxónmi a druhmi existujú rôzne variácie. Pseudouridín je v snRNA prítomný v miestach, ktoré sa účastnia interakcií RNA-RNA a RNA-bielkovina, ktoré sprostredkovávajú skladanie a funkciu spliceozómu. Prítomnosť pseudouridínu v snRNA prispieva k správnemu skladaniu spliceozómu, ktorý je nevyhnutný pre spracovanie pre-mRNA.
Pseudouridínsyntázy
[upraviť | upraviť zdroj]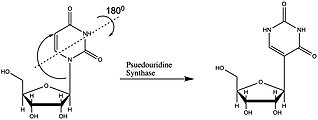
RNA modifikácie na pseudouridín vznikajú posttranskripčne, teda po vytvorení RNA. Bielkoviny, ktoré sprostredkovávajú tieto modifikácie, sa nazývajú pseudouridínsyntázy alebo PUS, a reakcia, ktorú katalyzujú, sa nazýva pseudouridylácia. Tieto proteíny sa nachádzajú vo všetkých ríšach života. Väčšina výskumov týchto enzýmov sa zameriavala na modifikácie tRNA, takže mechanizmy ich pôsobenia na snRNA a mRNA nie sú jasne pochopené. Pseudouridínsyntázy sa líšia vo svojej špecificite, štruktúre a mechanizmoch izomerizácie. Rôzne štruktúry sú rozdelené do šiestich rodín (TruA, TruB, TruD, RluA, RsuA a Pus10).[8] Enzýmy z rodiny RsuA boli nájdené len u baktérií a Pus10 len u archeónov.[8] Tieto rodiny zdieľajú aktívnu sekvenciu a dôležité štruktúrne motívy.[12]
TruA
[upraviť | upraviť zdroj]TruA doména modifikuje rôzne miesta v tRNA, snRNA a mRNA. Mechanizmus izomerizácie uridínu nie je jasne popísaný.[8][13]
PUS 1 sa nachádza v jadre a modifikuje tRNA na rôznych miestach, U44 v U2 snRNA a U28 v U6 snRNA. Štúdie ukázali, že expresia PUS 1 sa zvyšuje počas environmentálneho stresu a je dôležitá v regulácii zostrihu RNA. Okrem toho je PUS 1 nevyhnutná pre presun tRNA vytvorenej v jadre do cytoplazmy.[8]

PUS 2 je podobná PUS 1, ale nachádza sa v mitochondriách a modifikuje len U27 a U28 v mito-tRNA. Tento proteín modifikuje mitochondriálnu tRNA, ktorá má menšie množstvo modifikácií na pseudouridín v porovnaní s inými tRNA. Na rozdiel od väčšiny proteínov nachádzajúcich sa v mitochondriách nebol u PUS 2 objavený mitochondriálny cieliaci signál (MTS).[8]
PUS 3 je homológ PUS 1, ale modifikuje iné miesta v tRNA (U38/U39) v cytoplazme a mitochondrii. Tento proteín je z celej TruA rodiny najzachovávanejší medzi rôznymi druhmi. Keď sa tRNA nesprávne zloží, objavuje sa menej modifikácii týmto enzýmom. Okrem tRNA pôsobí tento proteín i na ncRNA a mRNA, ale stále je nutný ďalší výskum na určenie dôležitosti týchto modifikácií. PUS 3 a PUS 1 u ľudí modifikujú RNA aktivujúcu steroidový receptor.[8]
TruB
[upraviť | upraviť zdroj]Rodina TruB obsahuje len PUS 4, ktorý sa nachádza v mitochondrii a jadre. Modifikácie spôsobené PUS 4 sa nachádzajú na U55 v tRNA. U ľudí v PUS 4 v skutočnosti chýba väzbová doména nazývaná PUA alebo pseudouridínsyntáza a archeozíntransglykozyláza. PUS 4 má sekvenčnú špecificitu pre T-slučku tRNA. Predbežné dáta naznačujú, že PUS 4 modifikuje mRNA, ale na potvrdenie bude potrebný ďalší výskum. PUS 4 takisto viaže vírus stoklasovej mozaiky, čo je RNA vírus napadajúci rastliny.[8][14]
TruD
[upraviť | upraviť zdroj]Jediným členom rodiny TruD je PUS 7, ktorý je schopný modifikovať rôzne molekuly RNA, ale nie je jasné, ako sú tieto rôzne substráty rozpoznávané. PUS 7 modifikuje U2 snRNA na pozícii 35 a tieto modifikácie sú bežnejšie, keď sú bunky v teplotnom šoku. Ďalšou modifikáciou je cytoplazmatická tRNA na pozícii 13 a pozícia 35 v pre-tRNATyr. Takisto modifikuje i niektoré mRNA. PUS 7 modifikuje uridín v rôznych sekundárnych štruktúrach, takže sa zdá, že toto nie je rozhodujúci faktor pri určovaní špecificity. Vyzerá to tak, že PUS 7 rozpoznáva konkrétnu sekvenciu, a to UGUAR (kde R je častejšie G než A), v ktorej je druhý uridín modifikovaný na pseudouridín. Pseudouridylácia mRNA týmto enzýmom sa zvyšuje pri teplotnom šoku, pretože sa tento enzým presúva z jadra do cytoplazmy. Predpokladá sa, že táto modifikácia zvyšuje stabilitu mRNA počas teplotného šoku, než sa RNA presunie do jadra alebo mitochondrie, ale na potvrdenie je nutný ďalší výskum.[8][13]
RluA
[upraviť | upraviť zdroj]Rodina RluA je najväčšia rodina pseudouridínsyntáz. Tieto proteíny identifikujú svoje substráty tak, že po naviazaní na ne dosiahnu väzbovú špecificitu pomocou „nanútenia“ novej štruktúry svojmu substrátu.[12]
PUS 5 nie je poriadne preštudovaná pseudouridínsyntáza. Podobne ako PUS 2 nemá mitochondriálnu cieliacu sekvenciu. Tento proteín modifikuje U2819 v mitochondriálnej 21S rRNA.[8] Takisto sa predpokladá, že modifikuje mRNA, ale na potvrdenie bude potrebný ďalší výskum.
PUS 6 modifikuje U31 cytoplazmatickej i mitochondriálnej tRNA. PUS 6 takisto modifikuje i mRNA.[8]
PUS 8 upravuje cytoplazmatickú tRNA na pozícii U32. Na C-konci má DRAP-deaminázovú doménu, ktorá sa účastní biosyntézy riboflavínu. Táto doména, ktorá je príbuzná riboflavínsyntáze, má úplne odlišnú funkciu a nie je známe, či interaguje s druhou doménou (pseudouridínsyntázovou). PUS 8 je nevyhnutná v kvasinkách, ale predpokladá sa, že je to kvôli syntéze riboflavínu a nie pseudouridylácii.[8]
PUS 9 katalyzuje pseudouridyláciu na tej istej pozícii, ako PUS 8, ale je lokalizovaná v mitochondriách namiesto cytoplazmy. Je to jediný PUS proteín, ktorý obsahuje mitochondriálny cieliaci signál na N-konci. Štúdie predpokladjú, že PUS 9 môže modifikovať i mRNA, čo by znamenalo menšiu substrátovú špecificitu.[8]
Techniky sekvenovania genómu pre pseudouridín
[upraviť | upraviť zdroj]Pseudouridín sa dá identifikovať mnohými technikami. Bežnou technikou detekcie modifikácií RNA a DNA je kvapalinová chromatografia s hmotnostným spektrometrom (LC-MS). Hmotnostná spektrometria rozdeľuje molekuly podľa hmotnosti a náboj. Uridín a pseudouridín majú rovnakú hmotnosť, ale majú rôzne náboje. Kvapalinová chromatografia ich rozlišuje podľa retenčného času, ktorý popisuje, ako rýchlo opúšťajú kolónu.[15] Chemicky je možné pseudouridín identifikovať pomocou CMC (N-cyklohexyl-N'-β-(4-metylmorfolínium)etylkarbodiimidu), ktorý špecificky označuje a rozlišuje uridín od pseudouridínu. CMC sa viaže na oba, ale pevnejšie sa viaže na pseudouridín, keďže sa môže tvoriť vodíková väzba na dusík. CMC viazaný na pseudouridín sa potom môže zobraziť pomocou označenia signálnou molekulou. Táto metóda sa stále vylepšuje, aby sa zvýšila jej výkonnosť.[16]
Medicinálny význam pseudouridínu
[upraviť | upraviť zdroj]Pseudouridín vykazuje slabý, ale významný, vplyv na cukorfosfátovú kostru vo svojej blízkosti a takisto zlepšuje skladanie báz. Tieto účinky pravdepodobne stoja za biologickým významom väčšiny, ale asi nie všetkých, pseudouridínov v RNA. Niektorí genetické mutanti, ktorým chýbajú konkrétne pseudouridínové reziduá v tRNA alebo rRNA, vykazujú problémy s transláciou, pomaly rastú alebo nedostatočne konkurujú divým variantom v zmiešanej kultúre. Pseudouridínové modifikácie sú takisto implikované v niektorých ľudských poruchách, napríklad mitochondriálna myopatia a sideroblastická anémia (MLASA) a dyskeratosis congenita.[8] Dyskeratosis congenita a Hoyeraal-Hreidarssonov syndróm sú dve vzácne dedičné choroby, ktoré sú spôsobené mutáciou v géne DKC1, ktorý kóduje pseudouridínsyntázu s názvom dyskerín. Pseudoudirín takisto regulujue latenciu vírusových procesov pri infekcii vírusom HIV.[17] Pseudouridylácia bola takisto spojená s patogenézou maternálne dedeného diabetu a hluchoty (MIDD). Konkrétne ide o bodovú mutáciu v mitochondriálnej tRNA, ktorá evidentne blokuje pseudouridyláciu jedného nukleotidu, čím dochádza k zmene terciárnej štruktúry tRNA. To môže viesť k väčšej nestabilite tRNA, ktorá má za následok nedostatky mitochondriálnej translácie a respirácie.[17]
Vakcíny
[upraviť | upraviť zdroj]Keď sa v syntetickej mRNA použije pseudouridín namiesto uridínu, modifikovaná mRNA vzbudzuje menšiu odozvu od Toll-like receptorov, ktoré sú súčasťou ľudského imunitného systému, ktoré by inak túto mRNA označili ako nevítanú. Vďaka tomu je pseudouridín užitočný vo vakcínach, vrátane mRNA vakcín na COVID-19. Túto vlastnosť pseudouridínu objavili Katalin Karikóová a Drew Weissman v roku 2005[18] a v roku 2023 bol ich objav ocenený Nobelovou cenou za fyziológiu alebo medicínu.[19]
N1-Metylpseudouridín spôsobuje ešte slabšiu odpoveď od imunitného systému než Ψ a zároveň zlepšuje translačnú kapacitu.[20] mRNA vakcíny od Pfizer/BioNTech a Moderny teda využívajú N1-metylpseudouridín namiesto pseudouridínu.[20]
Referencie
[upraviť | upraviť zdroj]- ↑ Pseudouridín [online]. arl4.library.sk, [cit. 2022-05-12]. Dostupné online.
- ↑ PENZO, Marianna; GUERRIERI, Ania; ZACCHINI, Federico. RNA Pseudouridylation in Physiology and Medicine: For Better and for Worse. Genes, 2017-11-01, roč. 8, čís. 11, s. 301. Dostupné online [cit. 2022-05-12]. ISSN 2073-4425. DOI: 10.3390/genes8110301. (po anglicky)
- ↑ a b PENZO, Marianna; GUERRIERI, Ania; ZACCHINI, Federico. RNA Pseudouridylation in Physiology and Medicine: For Better and for Worse. Genes, 2017-11-01, s. 301. Dostupné online. ISSN 2073-4425. DOI: 10.3390/genes8110301. PMID 29104216. (po anglicky)
- ↑ a b c d e GRAY, Michael Charette, Michael W.. Pseudouridine in RNA: What, Where, How, and Why. IUBMB Life, 2000-05-01, s. 341–351. ISSN 1521-6543. DOI: 10.1080/152165400410182. PMID 10902565.
- ↑ PENZO, Marianna; GUERRIERI, Ania; ZACCHINI, Federico. RNA Pseudouridylation in Physiology and Medicine: For Better and for Worse. Genes, 2017-11-01, roč. 8, čís. 11, s. 301. Dostupné online [cit. 2022-05-12]. ISSN 2073-4425. DOI: 10.3390/genes8110301. (po anglicky)
- ↑ DAVIS, Darrell R.. Stabilization of RNA stacking by pseudouridine. Nucleic Acids Research, 1995, s. 5020–5026. Dostupné online. ISSN 0305-1048. DOI: 10.1093/nar/23.24.5020. PMID 8559660. (po anglicky)
- ↑ RNA pseudouridylation: new insights into an old modification. Trends in Biochemical Sciences, April 2013, s. 210–218. ISSN 0968-0004. DOI: 10.1016/j.tibs.2013.01.002. PMID 23391857.
- ↑ a b c d e f g h i j k l m n Eukaryotic stand-alone pseudouridine synthases – RNA modifying enzymes and emerging regulators of gene expression?. RNA Biology, 2017-01-03, s. 1185–1196. ISSN 1547-6286. DOI: 10.1080/15476286.2016.1276150. PMID 28045575.
- ↑ TheTORsignaling pathway regulates starvation-induced pseudouridylation of yeast U2 snRNA. RNA, 2016-06-07, s. 1146–1152. ISSN 1355-8382. DOI: 10.1261/rna.056796.116. PMID 27268497.
- ↑ Post-transcriptional pseudouridylation in mRNA as well as in some major types of noncoding RNAs. Biochimica et Biophysica Acta (BBA) - Gene Regulatory Mechanisms, March 2019, s. 230–239. ISSN 1874-9399. DOI: 10.1016/j.bbagrm.2018.11.002. PMID 30414851.
- ↑ European medicines Agency Assessment report on Comirnaty (Common name: COVID-19 mRNA vaccine) (nucleoside-modified) Procedure No. EMEA/H/C/005735/0000 [online]. 2021-02-19. Dostupné online.
- ↑ a b Pseudouridine Synthases. Chemistry & Biology, November 2006, s. 1125–1135. ISSN 1074-5521. DOI: 10.1016/j.chembiol.2006.09.009. PMID 17113994.
- ↑ a b RNA Pseudouridylation in Physiology and Medicine: For Better and for Worse. Genes, 2017-11-01, s. 301. ISSN 2073-4425. DOI: 10.3390/genes8110301. PMID 29104216.
- ↑ RNA modification enzyme TruB is a tRNA chaperone. Proceedings of the National Academy of Sciences, 2016-11-14, s. 14306–14311. ISSN 0027-8424. DOI: 10.1073/pnas.1607512113. PMID 27849601.
- ↑ Quantification of Pseudouridine Levels in Cellular RNA Pools with a Modified HPLC-UV Assay. Genes, 2017-09-05, s. 219. ISSN 2073-4425. DOI: 10.3390/genes8090219. PMID 28872587.
- ↑ KALSOTRA, Auinash. Faculty of 1000 evaluation for Transcriptome-wide mapping reveals widespread dynamic-regulated pseudouridylation of ncRNA and mRNA.. 2016-11-02. DOI:10.3410/f.718875945.793524920
- ↑ a b Pseudouridylation of 7 SK sn RNA promotes 7 SK sn RNP formation to suppress HIV ‐1 transcription and escape from latency. EMBO Reports, October 2016, s. 1441–1451. ISSN 1469-221X. DOI: 10.15252/embr.201642682. PMID 27558685.
- ↑ DOLGIN, Elie. The tangled history of mRNA vaccines. Nature, September 14, 2021. Dostupné online.
- ↑ Press release: The Nobel Prize in Physiology or Medicine 2023 [online]. nobelprize.org, 2023-10-02, [cit. 2023-10-05]. Dostupné online. (po anglicky)
- ↑ a b The Critical Contribution of Pseudouridine to mRNA COVID-19 Vaccines. Frontiers in Cell and Developmental Biology, 2021, s. 789427. DOI: 10.3389/fcell.2021.789427. PMID 34805188.
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Pseudouridine na anglickej Wikipédii.
