Konjugovaný pár
| Kyseliny a zásady |
|---|

|
| Acidobázická homeostáza • Acidobázická reakcia • Amfotérna zlúčenina • Autoprotolýza vody • Disociačná konštanta • Extrakcia • Frustrovaný Lewisov pár • Funkcia kyslosti • Hammettova funkcia kyslosti • Chirálna Lewisova kyselina • Katalýza Lewisovou kyselinou • Konjugovaný pár • Kyselina • pH • Protónová afinita • Rovnovážna chémia • Sila kyselín • Titrácia • Tlmivý roztok • Zásada |
| Druhy kyselín |
| Brønsted–Lowry • Lewis • Akceptor • Minerálne • Organické • Oxidy • Silné • Slabé • Superkyseliny • Pevné |
| Druhy zásad |
| Brønsted–Lowry • Lewis • Donor • Organické • Oxidy • Silné • Slabé • Superzásady • Nenukleofilné |
Konjugovaný pár je v Brønstedovej teórii dvojica kyseliny a zásady, ktoré sa líšia o jeden protón (katión H+).[1] Keď kyselina odštiepi protón, vzniká z nej konjugovaná zásada (vzniká totiž zásada schopná protón prijať), a naopak, keď zásada prijme protón, vzniká z nej konjugovaná kyselina (ktorá je zase schopná protón odovzdať).[2] Keďže niektoré kyseliny môžu odštiepiť viac protónov (sú to viacsýtne kyseliny), môžu i konjugované zásady byť kyseliny. Amfotérne rozpúšťadlá môžu tvoriť konjugovanú kyselinu i konjugovanú zásadu,[3] tento vzťah teda popisuje relatívnu polohu protónu medzi dvoma látkami.
Konjugované páry možno zapísať nasledujúcou chemickou rovnicou:
Johannes Nicolaus Brønsted a Martin Lowry publikovali svoju teóriu kyselín a zásad, podľa ktorej je každá látka schopná odštiepiť protón kyselinou a látka, ktorá tento protón príjme, je zásadou. Protón je nukleón, ktorý má kladný náboj, a často sa značí ako H+, pretože sa z neho skladá jadro atómu vodíka,[4] teda vodíkový katión. (Vodíkový katión však môže obsahovať i jeden alebo dva neutróny, súhrnný názov pre všetky vodíkové katióny je hydrón.)
Katión môže byť konjugovanou kyselinou a anión môže byť konjugovanou zásadou, podľa toho, o akú látku ide a podľa ktorej acidobázickej teórie je hodnotená. Najjednoduchším aniónom, ktorý môže byť konjugovanou zásadou, je solvatovaný elektrón, ktorého konjugovaná kyselina je atóm vodíka.
Acidobázické reakcie
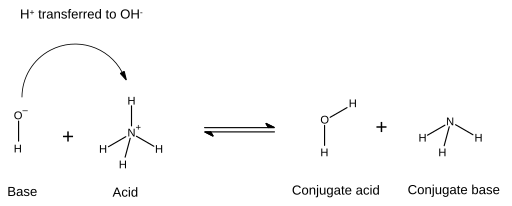
[upraviť | upraviť zdroj]V acidobázických reakciách reaguje kyselina so zásadou, čím vzniká konjugovaná zásada a konjugovaná kyselina. Kyselina stráca protón a zásada ho prijíma. V chemických diagramoch sa táto nová väzba, ktorá vzniká medzi zásadou a protónom, naznačuje šípkou, ktorá začína u elektrónového páru zásady a končí u protónu (vodíkového katiónu), ktorý sa prenáša:
V tomto prípade je voda konjugovanou kyselinou hydroxidového iónu po tom, čo prijíme vodíkový katión od amónneho katiónu. Amoniak je konjugovanou zásadou amónneho katiónu (amónia), ktorý je v tomto prípade kyselinou a odovzdal protón hydroxidovému aniónu. V opačnej reakcii, teda reakcii medzi vodou a amoniakom, možno hydroxidový anión pokladať za konjugovanú zásadu vody, pretože voda stráca protón. Amónny katión je potom konjugovanou kyselinou amoniaku, ktorá vzniká po prijatí protónu. Označenia „kyselina“, „zásada“, „konjugovaná kyselina“ a „konjugovaná zásada“ teda nie sú nemenné a závisia na reagujúcich látkach a prebiehajúcich reakciách.
Sila konjugovaných kyselín a zásad
[upraviť | upraviť zdroj]Sila konjugovanej kyseliny je priamo závislá na jej disociačnej konštante.[5] Ak je konjugovaná kyselina silná, jej disociácia bude mať vyššiu rovnovážnu konštantu a teda budú zvýhodnené produkty reakcie. Sila konjugovanej zásady sa dá popísať ako tendencia látky „priťahovať“ protóny. Ak je konjugovaná kyselina silná, bude štiepiť protón len veľmi ťažko a v roztoku jej kyselina bude disociovať len málo.
Ak je látka silnou kyselinou, jej konjugovaná zásada bude slabá.[6] Príkladom je disociácia kyseliny chlorovodíkovej, HCl, vo vode. Keďže HCl je silná kyselina (disociuje prakticky úplne), jej konjugovaná zásada (chloridový anión, Cl-) bude slabou konjugovanou zásadou. Preto bude v tomto systéme väčšina vodíkových katiónov, H+, viazaná na vodu v podobe oxónia, H3O+, namiesto viazaného na chloridový anión. Konjugovaná zásada je slabšia než voda.
Naopak, ak je látka klasifikovaná ako slabá kyselina, jej konjugovaná zásada nemusí byť silnou zásadou. Napríklad v prípade octanu, konjugovanej zásady kyseliny octovej, má disociačná konštanta Kb hodnotu blízku 5,6×10−10, takže je to slabá zásada. Aby látka mala silnú konjugovanú zásadu, musí byť veľmi slabou kyselinou, ako je to napríklad u vody.
Určovanie konjugovaných párov
[upraviť | upraviť zdroj]Na určenie konjugovaných páov je nutné pozrieť sa na podobné látky. Acidobázické reakcie je možné vnímať ako „stav pred“ a „stav po“. „Stav pred“ predstavujú reaktanty, „stav po“ predstavujú produkty danej reakcie. Konjugovaná kyselina na strane produktov (v „stave po“) prijíma vodíkový ión, takže na strane reaktantov (v „stave pred“) je zásadou tá látka, ktorý má o jeden protón menej než daná konjugovaná kyselina.Konjugovaná zásada na strane produktov (v „stave po“) naopak stráca vodíkový ión a prislúcha k nej látka na strane reaktantov (v „stave pred“), ktorá má o jeden vodíkový ión viac, čo z nej robí kyselinu.
V tejto reakcii
- HNO3 + H2O → H3O+ + NO3-
je kyselina dusičná kyselina, pretože štiepi protón, ktorý prijíma molekula vody, a jej konjugovanou zásadou je dusičnan (NO3-). Molekula vody je v tejto reakcii zásada, pretože prijíma vodíkový katión (protón) a jej konjugovanou kyselinou je oxónium (H3O+).
| Reakcia | Kyselina | Zásada | Konjugovaná zásada | Konjugovaná kyselina |
|---|---|---|---|---|
| HClO2 + H2O → ClO2- + H3O+ | HClO2 | H2O | ClO2- | H3O+ |
| ClO- + H2O → HClO + OH- | H2O | ClO- | OH- | HClO |
| HCl + H2PO4- → Cl- + H3PO4 | HCl | H2PO4- | Cl- | H3PO4 |
Použitie
[upraviť | upraviť zdroj]Jedno z použití konjugovaných párov je v príprave tlmivých roztokov (pufrov). V pufroch sa používa slabá kyselina a jej konjugovaná zásada (v podobe soli) alebo slabá zásada a jej konjugovaný kyselina na obmedzenie zmeny pH počas titrácií. Pufre majú organické i neorganické použitie. Okrem tlmivých roztokov v laboratóriu je významným tlmivým roztokom napríklad ľudská krv, ktorá si udržiava približne rovnaké pH.[5] Najdôležitejšou súčasťou tlmivého roztoku krvi je bikarbonátový tlmivý systém, ktorý pomáha predchádzať veľkým zmenám pH, keď sa do krvi dostane oxid uhličitý (CO2).[7] Prebieha nasledovná reakcia:
Bikarbonátový pufrový systém je hlavným tlmivým roztokom v extracelulárnom priestore. Hlavnými intracelulárnymi pufrovacími látkami sú fosforečnany a proteíny.[7]
Nižšie v tabuľke sú najpoužívanejšie pufre:
| Tlmivá látka | pKa | Použiteľné rozpätie pH |
|---|---|---|
| Kyselina citrónová | 3,13, 4,76, 6,40 | 2,1 – 7,4 |
| Kyselina octová | 4,8 | 3,8 – 5,8 |
| KH2PO4 | 7,2 | 6,2 – 8,2 |
| CHES | 9,3 | 8,3 – 10,3 |
| Kyselina boritá | 9,24 | 8,25 – 10,25 |
Tlmivé roztoky sa vytvárajú i s organickými zlúčeninami, ako je to napríklad s kyselinou octovou. Kyselina octová, CH3COOH, je slabá kyselina, ktorú možno zmiešať s roztokom jej konjugovanej zásady, CH3COO-, v podobe soli, napríklad octanu sodného. Výsledný roztok je zmesou kyseliny octovej a octanu sodného a nazýva sa octanový pufer.[8] Okrem kyseliny octovej možno použiť mnohé iné slabé organické kyseliny, ktoré sa používajú na tvorbu rôznych tlmivých roztokov vhodných pre rôzne rozmedzia pH.
Ringerov roztok je príkladom roztoku, v ktorom sa organická kyselina, kyselina mliečna, CH3CH(OH)COOH, zmieša so sodnými, draselnými a vápenatými katiónmi a chloridovými anióni v destilovanej vode.[9] Tým vzniká roztok, ktorý je izotonický voči ľudskej krvi a používa sa na dopĺňanie tekutín po strate krvi kvôli úraze, operácii alebo popálení.[10]
Zoznam kyselín a ich konjugovaných zásad
[upraviť | upraviť zdroj]V tabuľke nižšie je zoznam niekoľkých kyselín a ich konjugovaných zásad. Všetky páry sa líšia len o vodíkový katión (H+), čo z nich robí konjugovaný pár. Sila kyselín sa znižuje a sila konjugovanej zásady rastie v tabuľke smerom dole.
| Kyselina | Konjugovaná zásada | ||
|---|---|---|---|
| Vzorec | Názov | Vzorec | Názov |
| H2F+ | Fluorónium | HF | Fluorovodík |
| HCl | Chlorovodík | Cl− | Chlorid |
| H2SO4 | Kyselina sírová | HSO− 4 |
Hydrogensíran |
| HNO3 | Kyselina dusičná | NO− 3 |
Dusičnan |
| H3O+ | Oxónium | H2O | Voda |
| HSO− 4 |
Hydrogensíran | SO2− 4 |
Síran |
| H3PO4 | Kyselina fosforečná | H2PO− 4 |
Dihydrogenfosforečnan |
| CH3COOH | Kyselina octová | CH3COO− | Octan |
| HF | Fluorovodík | F− | Fluorid |
| H2CO3 | Kyselina uhličitá | HCO− 3 |
Hydrogenuhličitan |
| H2S | Sulfán | HS− | Hydrogensulfid |
| H2PO− 4 |
Dihydrogenfosforečnan | HPO2− 4 |
Hydrogenfosforečnan |
| NH+ 4 |
Amónium | NH3 | Amoniak |
| H2O | Voda (pH = 7) | OH− | Hydroxid |
| HCO− 3 |
Hydrogenuhličitan | CO2− 3 |
Uhličitan |
Zoznam zásad a ich konjugovaných kyselín
[upraviť | upraviť zdroj]V tabuľke nižšie je zoznam niekoľkých zásad a ich konjugovaných kyselín. Sila zásady sa znižuje a sila konjugovanej kyseliny rastie v tabuľke smerom dole.
| Zásada | Konjugovaná kyselina | ||
|---|---|---|---|
| Vzorec | Názov | Vzorec | Názov |
| C2H5NH2 | Etylamín | C2H5NH3+ | Etylamónium |
| CH3NH2 | Metylamín | CH3NH3+ | Metylamónium |
| NH3 | Amoniak | NH4+ | Amónium |
| C5H5N | Pyridín | C5H6N+ | Pyridínium |
| C6H5NH2 | Anilín | C6H5NH3 | Fenylamónium |
| C6H5COO- | Benzoát | C6H5COOH | Kyselina benzoová |
| F- | Fluorid | HF | Fluorovodík |
| PO3− 4 |
Fosforečnan | HPO2− 4 |
Hydrogenfosforečnan |
| OH− | Hydroxid | H2O | Voda (pH = 7) |
| HCO3- | Hydrogenuhličitan | H2CO3 | Kyselina uhličitá |
| CO32- | Uhličitan | HCO3- | Hydrogenuhličitan |
| Br- | Bromid | HBr | Bromovodík |
| HPO2− 4 |
Hydrogenfosforečnan | H2PO− 4 |
Dihydrogenfosforečnan |
| Cl− | Chlorid | HCl | Chlorovodík |
| H2O | Voda (pH = 7) | H3O+ | Oxónium |
| NO2- | Dusitan | HNO2 | Kyselina dusitá |
Referencie
[upraviť | upraviť zdroj]- ↑ Brönstedova teória. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 151.
- ↑ Zumdahl, Stephen S., & Zumdahl, Susan A. Chemistry. Houghton Mifflin, 2007, ISBN 0618713700
- ↑ amfotérne zlúčeniny. In: BÍNA, Jaroslav. Malá encyklopédia chémie. Bratislava : Obzor, 1981. S. 91.
- ↑ Brønsted–Lowry theory | chemistry [online]. . Dostupné online. (po anglicky)
- ↑ a b VOET, Donald. Biochemistry. Hoboken, NJ : John Wiley & Sons, 2011. (4th edition.) Dostupné online. ISBN 978-0-470-57095-1. S. 45, 48.
- ↑ Strength of Conjugate Acids and Bases Chemistry Tutorial [online]. . Dostupné online.
- ↑ a b WIDMAIER, Eric P.. Vander's human physiology : the mechanisms of body function. New York, NY : [s.n.], 2016. (Fourteenth edition.) Dostupné online. ISBN 978-1-259-29409-9. S. 517.
- ↑ Acetate Buffer (pH 3.6 to 5.6) Preparation and Recipe | AAT Bioquest [online]. www.aatbio.com, [cit. 2022-12-04]. Dostupné online.
- ↑ British national formulary: BNF 69. 69. vyd. [s.l.] : British Medical Association, 2015. ISBN 9780857111562. S. 683.
- ↑ PESTANA, Carlos. Pestana's Surgery Notes. Fifth. vyd. [s.l.] : Kaplan Medical Test Prep, 7 April 2020. ISBN 978-1506254340. S. 4–5.
Pozri aj
[upraviť | upraviť zdroj]Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Conjugate (acid-base theory) na anglickej Wikipédii.