Bielkovina


Bielkovina alebo proteín je vysokomolekulárna prírodná látka, ktorej základ tvorí jeden alebo viac reťazcov zložených z jednotlivých aminokyselín. Z chemického hľadiska ide o kopolyméry (kombinované polyméry) z monomerných jednotiek L-α-aminokyselín spojených peptidovými väzbami. Molekulová hmotnosť jednoreťazcových bielkovín je medzi 10 000 a 100 000 Da, u viacreťazcových bielkovín až do niekoľkých miliónov Da.[5]
Lineárny reťazec aminokyselín sa nazýva polypeptid, pričom každá bielkovina obsahuje minimálne jeden polypeptid. Menšie peptidy, obsahujúce do 50 aminokyselín, sú málokedy považované za proteíny a nazývajú sa skôr peptidy alebo polypeptidy. Sekvencie aminokyselín jednotlivých bielkovín sú v organizmoch kodované génmi, pričom jeden gén môže kódovať viacero proteínov. Reťazec bielkoviny je syntetizovaný procesom tzv. translácie, po ktorej nasleduje zbalenie proteínu (tzv. folding) do fyziologicky funkčnej trojdimenzionálnej štruktúry. Bielkoviny môžu byť chemicky modifikované posttranslačne, typicky modifikáciou postranných reťazcov aminokyselín alebo pripojením molekúl neproteínového charakteru.[5]
Po syntéze plnia proteíny nejaký čas v organizme svoju funkciu a následne sú degradované. Priemerný čas života proteínov je vyjadrovaný ako biologický polčas a ten sa proteín od proteínu odlišuje – jeho rozmedzie prechádza od niekoľko minút po roky. Abnormálne alebo zle zbalené proteíny sú bunkami fyziologicky rýchlo rozpoznané a sú degradované vo veľmi krátkom čase.[5]
Bielkoviny zastávajú v organizme pestrú paletu funkcií a podobne ako iné biomakromolekuly, sú pre život esenciálne. Sú dôležité pre energetický metabolizmus, bunkový cyklus, transportné mechanizmy, imunitu, bunkovú signalizáciu, majú regulačné aj stavebné funkcie.[5]
Tradičné delenia
[upraviť | upraviť zdroj]Delenie podľa štruktúry (tvaru molekuly):[6][7][8][9][10][11]
- globulárne bielkoviny/proteíny (guľovité bielkoviny/proteíny, sféroproteíny) – majú guľovitý tvar, väčšinou sú rozpustné vo vode a zriedených soľných roztokoch; patria sem najmä enzýmy a albumíny, globulíny, históny, protamíny, glutelíny a prolamíny. Z iného hľadiska sa delia na cytochróm c, krvné proteíny (sérový albumín, glykoproteíny, protilátky, hemoglobín, hormóny), enzýmy a výživové bielkoviny.
- fibrilárne bielkoviny/proteíny (vláknité bielkoviny/proteíny, skleroproteíny, štruktúrne bielkoviny/proteíny) – majú vláknitý tvar, nikdy nie sú rozpustné vo vode a zriedených soľných roztokoch; patria sem: kolagény, keratíny, elastíny a iné (napr. fibrín, tropomyozín)
- špeciálna skupina: membránové bielkoviny/proteíny – bielkoviny naviazané na biologickú membránu a funkčne s ňou súvisiace
Delenie podľa zloženia:[6][10][11][12][13][14]
- jednoduché bielkoviny/proteíny (staršie: proteíny v užšom zmysle, holoproteíny[pozn 1]) – sú to bielkoviny neobsahujúce nepeptidovú zložku; môžu to by globulárne alebo fibrilárne bielkoviny; podľa rozpustnosti sa delia na:
- globulárne jednoduché bielkoviny:
- albumíny – rozpustné vo vode
- globulíny (pseudoglobulíny a euglobulíny) – rozpustné v roztokoch solí, pseudoglobulíny sú rozpustné aj vo vode
- glutelíny – rozpustné v zriedených zásadách a kyselinách, nerozpustné vo vode
- prolamíny (gliadíny) – rozpustné v 70 – 80 % etanole, nerozpustné vo vode
- históny – rozpustné vo vode, nerozpustné v zriedenom roztoku NaOH
- protamíny – rozpustné vo vode
- fibrilárne bielkoviny (okrem 1 výnimky) – nerozpustné vo vode
- globulárne jednoduché bielkoviny:
- zložené bielkoviny/proteíny (konjugované bielkoviny/proteíny, staršie: proteidy, heteroproteíny) – sú to bielkoviny obsahujúce aj nepeptidovú zložku (sprav. tzv. prostetickú skupinu); všetky (až na 1 výnimku) patria medzi globulárne bielkoviny; patria sem:
- glykoproteíny (resp. mukoproteíny) – prostetické skupiny: galaktóza, manóza, fukóza
- lipoproteíny – prostetické skupiny: triglyceridy, cholesterol
- metaloproteíny – prostetické skupiny: ióny kovov
- fosfoproteíny – prostetická skupina: kyselina fosforečná
- nukleoproteíny – prostetické skupiny: nukleové kyseliny
- chromoproteíny – prostetická skupina: farbivová zložka; patria sem o. i. hemoproteíny (patria aj k metaloproteínom) a flavoproteíny
- špeciálna skupina: vírusové bielkoviny/proteíny (kapsidové bielkoviny)
Niekedy sa enzýmy vyčleňujú ako tretia skupina popri jednoduchých a zložených bielkovinách.[16]
Delenie podľa stavu:
prvá možnosť:[14]
- natívne bielkoviny/proteíny (prírodné bielkoviny/proteíny):
- denaturované bielkoviny/proteíny
- upravené bielkoviny/proteíny (modifikované bielkoviny/proteíny)
- natívne bielkoviny/proteíny (prírodné bielkoviny/proteíny):
- derivované bielkoviny – látky derivované z natívnych bielkovín vplyvom tepla, enzýmov alebo chemických činidiel:
- denaturované bielkoviny (primárne derivované bielkoviny):
- sekundárne derivované bielkoviny:
Delenie podľa biologickej funkcie:[14][19][20]
- enzymatické bielkoviny/proteíny (enzýmy) – katalyzujú biochemické reakcie metabolizmu, ide o najpočetnejšiu skupinu bielkovín
- transportné bielkoviny/proteíny – slúžia na dopravu kyslíka, mastných kyselín, hormónov, iónov kovov a elektrónov
- translokátorové bielkoviny/proteíny (membránové kanály a prenášače) – bielkoviny prenášajúce látky cez biologickú membránu
- skladovacie bielkoviny/proteíny (zásobné bielkoviny) – na skladovanie iónov kovov
- výživové bielkoviny/proteíny – zabezpečujú rezervu aminokyselín organizmu
- kontraktilné bielkoviny/proteíny (pohybové bielkoviny) – spôsobujú koordinovanú pohyblivosť niektorých orgánov (napr. svalov), organel alebo iných bunkových štruktúr (napr. chromatidy)
- štruktúrne bielkoviny (skleroproteíny, fibrilárne bielkoviny) – podstatná súčasť spojivového a podporného tkaniva[pozn 2]
- obranné bielkoviny – bielkoviny obranného a ochranného systému
- receptorové bielkoviny – prenášajú bunkové signály
- regulačné bielkoviny (regulátorové bielkoviny) – podieľajú sa na regulačných procesoch génovej aktivácie a rastu buniek
- bielkoviny povrchu buniek – sú významné pri morfogenéze a identifikácii cudzích tkanív
- faktory zrážania krvi a fibrinolýzy
- plazmatické bielkoviny/proteíny (plazmové bielkoviny/proteíny)
- svalové bielkoviny/proteíny
- mliečne bielkoviny/proteíny
- vaječné bielkoviny/proteíny
- ribozómové bielkoviny/proteíny
- bielkoviny/proteíny bunkového jadra
- membránové bielkoviny/proteíny
- mikrozómové bielkoviny/proteíny
Delenie podľa pôvodu (organizmu z ktorého pochádza):[7][9][14]
- rastlinné bielkoviny/proteíny
- živočíšne bielkoviny/proteíny
- netradičné bielkoviny/proteíny:
- bielkoviny z rias
- baktériové bielkoviny/proteíny
- vírusové bielkoviny/proteíny
Delenie z výživového hľadiska (podľa obsiahnutých aminokyselín):[14][22][23]
- plnohodnotné bielkoviny/proteíny (úplné bielkoviny/proteíny) – obsahujú všetky esenciálne aminokyseliny v správnom pomere; vajcové a mliečne bielkoviny
- takmer plnohodnotné bielkoviny/proteán – živočíšne svalové bilekoviny
- neplnohodnotné bielkoviny/proteíny – neobsahujú aspoň jednu esenciálnu aminokyselinu; všetky rastlinné bielkoviny a bielkoviny živočíšnych spojivových tkanív
Delenie podľa izolektrického bodu:[8]
- kyslé bielkoviny
- neutrálne bielkoviny
- bázické bielkoviny
Delenie podľa molekulovej hmotnosti:[8]
- malé bielkoviny – do 40 kDa
- veľké bielkoviny – nad 200 kDa
Funkcia
[upraviť | upraviť zdroj]Bielkoviny sa zúčastňujú všetkých procesov, ktoré sa odohrávajú v organizme na bunkovej aj extracelulárnej úrovni. Jednou z ich hlavných funkcií je urýchľovanie reakcií, na čo slúžia tzv. enzýmy. Ďalšie bielkoviny majú štruktúrnu (stavebnú) funkciu – tvoria napríklad na bunkovej úrovni bunkovú stenu, či cytoskelet, na úrovni celého organizmu napríklad chrupavky, vlasy alebo nechty. Iné bielkoviny majú za úlohu transport iných molekúl, či už v rámci bunky (napr. kinezíny a dyneíny) alebo v rámci celého organizmu (hemoglobín, haptoglobín). Bielkoviny môžu menšie molekuly aj skladovať (feritín, myoglobín). Ďalšie bielkoviny sú tzv. receptory, čo sú často transmembránové bielkoviny, na ktoré sa viažu tzv. ligandy (väčšinou iné bielkoviny alebo hormóny) a ktoré ďalej posielajú signál dnu do bunky, väčšinou na bielkoviny signálnych kaskád, ktoré signál amplifikujú a posielajú ďalej.[5]
Zloženie bielkovín
[upraviť | upraviť zdroj]
Absolútna väčšina bielkovín má hlavný reťazec (reťazce) zložený z 20 tzv. proteinogenných aminokyselín, ktoré majú spoločné niektoré dôležité vlastnosti. Všetky majú na α-uhlíku voči karboxyskupine pripojenú aminoskupinu, vodík a postranný reťazec, s výnimkou prolínu, ktorý má na α-uhlíku iminoskupinu. Kondenzáciou karboxyskupiny jednej a aminoskupiny druhej aminokyseliny vzniká tzv. peptidová (amidová) väzba. Po kondenzácii viacerých aminokyselín rozoznávame hlavný reťazec (tvorený karboxyskupinami, aminoskupinami a α-uhlíkmi) a postranné zvyšky, tvorené postrannými reťazcami jednotlivých aminokyselín. Kondenzácia aminokyselín prebieha ako dehydratácia, ktorej rovnovážna konštanta je naklonená v prospech samostatných aminokyselín, preto je proces translácie energeticky náročný. K samovoľnej hydrolýze polypeptidov nedochádza vďaka vysokej aktivačnej energii štiepenia peptidovej väzby. Peptidová väzba má vďaka rezonancii čiastočne dvojitý charakter, čím zabraňuje rotácii molekuly okolo nej. Vďaka tomu je možné rozlíšiť peptidovú väzbu trans a cis, pričom z energetického hľadiska absolútne prevažuje trans forma (pre prolín prevažuje tiež, ale menej). Koniec reťazca s karboxyskupinou sa nazýva C-koniec, opačný koniec sa podľa aminoskupiny nazýva N-koniec. Posttranslačnými modifikáciami môžu byť na aminokyselinové zvyšky pripojené rôzne chemicky odlišné skupiny – sacharidy, fosfát, acetát, molekuly lipidového charakteru a mnohé ďalšie.[5]
Okrem polypeptidového reťazca majú niektoré bielkoviny ďalšie súčasti, ktoré nie sú bielkovinového charakteru. Typicky to môže byť napríklad časť nukleovej kyseliny, polysacharid, fosfát, lipid, ión kovu alebo nejakú prostetickú skupinu.[24] Takéto bielkoviny sa potom označujú ako zložené bielkoviny alebo proteidy.[25] Bielkoviny, ktoré obsahovali výhradne polypeptidový reťazec, sa kedysi nazývali jednoduché bielkoviny.[26][27] Tieto označenia sa však aktuálne nepoužívajú.
Acidobázické vlastnosti bielkovín
[upraviť | upraviť zdroj]Bielkoviny obsahujú mnoho ionizovateľných skupín, na jednej strane v podobe N-koncovej aminoskupiny a C-koncovej karboxy skupiny, na druhej strane v podobe nabitých skupín postranných reťazcov kyselín asparágovej a glutámovej, lyzínu, arginínu a histidínu. Všetky tieto nabité skupiny sú schopné prijať alebo odštiepiť vodíkový katión a ovplyvňovať tak izoelektrický bod bielkoviny. Ten sa dá približne odhadnúť na základe počtu a chemického okolia jednotlivých nabitých skupín bielkoviny.[5]
Veľkosť a hmotnosť bielkovín
[upraviť | upraviť zdroj]
Veľkosť reťazcov peptidov a bielkovín varíruje medzi dvoma až tisícami aminokyselín, pričom veľkosť nijakým spôsobom nekoreluje s ich biologickou funkciou. Za najmenší biologicky dôležitý peptid je považovaný komerčne syntetizovaný dipeptid aspartám, ktorý pozostáva z L-aspartátu a metylesteru fenylalanínu a je známym umelým sladidlom. Mnoho hormónov sú malé peptidy, napríklad oxytocín a vazopresín, čo sú oligopeptidy pozostávajúce z deviatich aminokyselinových zvyškov. Priemerná dĺžka proteínov sa odlišuje medzi hlavnými taxónmi, pre archea je to 247 aminokyselín, baktérie 267 aminokyselín a eukaryoty až 361 aminokyselín.[28] Za najväčší proteín je považovaný titín dlhý skoro 27 000 aminokyselinových zvyškov, čo je dôležitý proteín svalov. Absolútna väčšina proteínov však obsahuje menej ako 2 000 aminokyselín. Niektoré tzv. viacpodjednotkové proteíny pozostávajú z viacerých reťazcov. Ak sú aspoň dva z týchto reťazcov rovnaké, ide o tzv. oligomérny proteín a jeho polypeptidové jednotky sú nazývané protoméry (typicky napr. hemoglobín). V opačnom prípade ide o proteínové komplexy. Vo výraznej väčšine viacpodjednotkových proteínov sú podjednotky spojené nekovalentnými interakciami, výnimočne môže ísť napr. o prepojenie disulfidickým mostíkom (inzulín, molekuly protilátky).[5]
Hoci priemerná relatívna molekulová hmotnosť aminokyselín po dehydratácii (mínus 18 za vodu) je 120, ich priemerná relatívna molekulová hmotnosť v proteínoch je len 110, čo je spôsobené tým, že v proteínoch sa vo väčšej miere vyskytujú menšie aminokyseliny. Hrubý odhad relatívnej molekulovej hmotnosti proteínu je preto možné urobiť vynásobením počtu jeho aminokyselinových zvyškov týmto číslom.[5]
Štruktúra bielkovín
[upraviť | upraviť zdroj]Usporiadanie bielkoviny v trojrozmernom priestore sa nazýva konformácia. Konformáciu je možné meniť napríklad rotáciou okolo jednoduchých väzieb, preto môže mať teoreticky každý proteín obrovské množstvo konformácii. Napriek tomu však fyziologicky prevažuje jedna alebo dve konformácie, pričom viacero fyziologicky umožnených konformácii iba odráža potrebu zmeny konformácie bielkoviny pre vykonávanie jej funkcie. Za daných podmienok dosahujú bielkoviny termodynamicky najstabilnejšiu konformáciu – čiže tú s najnižšou Gibbsovou energiou. O bielkovinách vo funkčne zbalenej konformácii sa hovorí, že sú v tzv. natívnom stave, ide o natívne proteíny. Napriek tomu, v mnohých prípadoch nemajú časti proteínov rozpoznateľnú štruktúru, v málo prípadoch ide o celé proteíny. Takéto časti alebo proteíny sa nazývajú vnútorne neusporiadané.[5]
Stabilizácia konformácie
[upraviť | upraviť zdroj]Stabilita proteínu znamená jeho tendencia udržať si natívnu konformáciu. Väčšina proteínov je len hranične stabilná – rozdiel Gibbsovej energie ich nezbaleného a zbaleného stavu za fyziologických podmienok je medzi 20 a 65 kJ/mol. Pre stabilizáciu proteínov sa ako esenciálne ukazujú byť disulfidické mostíky, hydrofóbna interakcia, interakcia opačne nabitých skupín a slabé interakcie.[5]
Disulfidové mostíky
[upraviť | upraviť zdroj]
Disulfidické mostíky sa fyziologicky tvoria oxidáciou dvoch postranných reťazcov aminokyseliny cysteínu za vzniku kovalentnej väzby medzi dvoma molekulami síry. Disulfidové mostíky sa tvoria fyziologicky iba v oxidatívnom prostredí, ktoré je u eukaryot prítomné iba extracelulárne – vnútri eukaryotických, ale aj bakteriálnych buniek preto nie je tvorba disulfidových mostíkov typická. Na druhej strane, často sú disulfidové mostíky tvorené u archea, pri ktorých sa predpokladá, že ide o adaptáciu na extrémne vysoké teploty, v ktorých tieto mikroorganizmy žijú.[5]
Hydrofóbna interakcia
[upraviť | upraviť zdroj]Hydrofóbna interakcia nie je v pravom zmysle interakcia, pretože nejde o tvorbu ani špecifickej, ani nešpecifickej väzby medzi atómami alebo molekulami, ale o efekt vyplývajúci zo zákonov termodynamiky, preto je aj výstižnejší názov hydrofóbny efekt. Voda, ktorá je fyziologickým rozpúšťadlom bielkovín, má zo všetkých známych molekúl najväčší potenciál tvorby vodíkových mostíkov. Ak voda obklopuje hydrofóbnu molekulu, usporadúva sa tak, aby stále vytvárala čo najväčší počet vodíkových mostíkov, čo však vedie k tvorbe vysoko organizovaného útvaru okolo hydrofóbnej molekuly. Zvýšená usporiadanosť znamená zníženú entropiu a znížená entropia znamená zvýšenie Gibbsovej energie. Keďže každý systém sa z hľadiska termodynamiky snaží dosiahnuť stav (konformáciu) s čo najnižšou Gibbsovou energiou, je pre bielkoviny výhodné skryť čo najviac hydrofóbnych aminokyselín dovnútra molekuly a na povrchu teda vystaviť čo najviac aminokyselín hydrofilných. Tento entropický efekt sa uplatňuje pri skladaní všetkých väčších proteínov a je hlavnou hybnou silou zbalovania proteínov.[5]
Interakcie nabitých aminokyselín
[upraviť | upraviť zdroj]
Interakcie polárnych molekúl môžu mať ako stabilizujúci, tak aj destabilizujúci efekt. Aminokyselinové zvyšky o opačnom náboji (kyseliny asparágová a glutámová záporný, lyzín, arginín a histidín kladný) tvoria tzv. iónové páry alebo soľné mostíky. Sila tejto priťažlivej interakcie stúpa s klesajúcou dielektrickou konštantou. Keďže dielektrická konštanta vody je vysoká (okolo 80), významné sú predovšetkým tzv. pochované soľné mostíky, čiže také, ktoré sa tvoria vnútri molekuly proteínu.[5]
Van der Waalsove interakcie
[upraviť | upraviť zdroj]Najvýznamnejšie van der Waalsove interakcie prispievajúce k stabilizácii proteínovej konformácie sú dipól-dipólové interakcie, predovšetkým vodíkové mostíky. Tieto interakcie sú čiastočne smerové a miera ich stabilizácie závisí na orientácii väzby medzi vodíkom a atómom, na ktorý je pripojený (typicky kyslík alebo síra) a polárnym atómom tvoriacim vodíkovú väzbu (typicky kyslík). Menej prispievajú slabšie van der Waalsove interakcie, tzv. Londonove disperzné sily, čo sú interakcie medzi dipólom a indukovaným dipólom alebo dvoma indukovanými dipólmi. Sila týchto interakcii klesá s dvanástou mocninou vzdialenosti dvoch atómov.[5]
Peptidová väzba
[upraviť | upraviť zdroj]Vďaka rezonancii dvojitej väzby medzi kyslíkom a uhlíkom karboxyskupiny (C) a uhlíkom karboxyskupiny a dusíkom aminoskupiny predchádzajúcej aminokyseliny sa nachádza 6 atómov tvoriacich peptidovú väzbu v jednej rovine a rotácia okolo väzby C-N nie je možná. Rotáciu okolo osi väzieb N-Cα a Cα-C popisujú tzv. dihedrálne uhly φ a ψ (v tomto poradí). Tieto uhly sa vynášajú na tzv. Ramachandranov graf, pričom z hľadiska konformácie sú možné iba ich isté kombinácie. Podľa toho, do ktorej skupiny kombinácii týchto dvoch uhlov patrí daná aminokyselina, je možné približne určiť, aký typ sekundárnej štruktúry tvorí.[5]
Úrovne štruktúry bielkovín
[upraviť | upraviť zdroj]V prípade bielkovín je možné hovoriť o jednotlivých úrovniach ich štruktúry. Štruktúra sa klasifikuje do štyroch úrovní, ktoré sú postupne zložitejšie.
Primárna štruktúra
Označuje len sekvenciu aminokyselín, ktoré tvoria proteín. Zapisuje sa od N-konca po C-koniec, typicky jednopísmenovými skratkami aminokyselín. Ostatné úrovne štruktúr sú na rozdiel od primárnej stabilizované aj nekovalentnými interakciami.[5]
Sekundárna štruktúra
[upraviť | upraviť zdroj]
Motív helix-slučka-helix je typický pre bielkoviny, ktoré viažu DNA
Sekundárna štruktúra hovorí o istom vybratom úseku polypeptidového reťazca a ide o lokálne priestorové usporiadanie atómov hlavného reťazca. Pravidelná sekundárna štruktúra sa objavuje, ak ostávajú dihedrálne uhly φ a ψ (približne) rovnaké určitý počet aminokyselín. Najčastejšie konformácie sú α-helix a β-skladaný list. α-helix je pravotočivá šróbovnicová štruktúra, v ktorej sú aminokyseliny usporiadané do špirály, pričom jedna otočka pripadá priemerne na 3,6 aminokyselinových zvyškov (11 atómov). Je výrazne stabilizovaný vodíkovými mostíkmi tvorenými medzi iminoskupinou a kyslíkom karboxyskupiny. β-skladaný list je takisto stabilizovaný vodíkovými mostíkmi a rozoznávame jeho dva typy – paralélny, v ktorom sú dva polypeptidové reťazce usporiadané vedľa seba v rovnakom smere a stabilnejší antiparalélny, v ktorom sú dva polypeptidové reťazce v smere opačnom. Ďalšou dôležitou štruktúrou je β-ohyb, pozostávajúci zo štyroch aminokyselín s častým výskytom prolínu a glycínu, pričom prvá a štvrtá tvoria vodíkovú väzbu, vďaka čomu je tvorený ohyb v polypeptidovom reťazci. Existujú aj ďalšie, minoritné typy sekundárnych štruktúr, ako π-helix, 3.10-helix a iné. Súbor viacerých sekundárnych štruktúr v istom približnom priestorovom usporiadaní tvorí tzv. motív, pričom jednotlivé motívy sa v bielkovinách opakujú. Jeden motív má často v rôznych bielkovinách podobnú biochemickú funkciu.[5]
Terciárna štruktúra
[upraviť | upraviť zdroj]Úplné trojdimenzionálne usporiadanie atómov v proteíne sa nazýva terciárna štruktúra. Terciárna štruktúra zahŕňa omnoho dlhší úsek aminokyselín ako sekundárna štruktúra. Aj aminokyseliny, ktoré sú navzájom v sekvencii veľmi vzdialené, môžu v konečnom dôsledku interagovať v priestore a stabilizovať bielkovinu, prípadne tvoriť jej dôležité funkčné miesto. V rámci molekuly proteínu je možné rozlíšiť tzv. domény. Doména je časť proteínu, ktorá je sama schopná vytvoriť nezávisle stabilnú terciárnu štruktúru.[5]
Kvartérna štruktúra
[upraviť | upraviť zdroj]Kvartérna štruktúra referuje o usporiadaní dvoch a viacerých polypeptidových reťazcov alebo podjednotiek.[5] Toto spojenie polypeptidových reťazcov je dané slabými medzimolekulovými interakciami.
Posttranslačné modifikácie
[upraviť | upraviť zdroj]Väčšina bielkovín nepozostáva len z jedného alebo viacerých polypeptidových reťazcov. Tieto reťazce sú ďalej chemicky modifikované, čím sa menia vlastnosti a funkčnosť daných bielkovín. Najčastejšou posttranslačnou modifikáciou je fosforylácia, čo znamená pripojenie fosfátovej (PO43-) skupiny fosfoesterovou väzbou na hydroxyskupinu serínu, treonínu alebo tyrozínu. Enzýmy, ktoré bielkoviny fosforylujú, sa nazývajú kinázy a enzýmy, ktoré bielkoviny naopak defosforylujú, čiže fosfátovú skupinu hydrolýzou odstraňujú, sa volajú fosfatázy. Fosforylácia je jedným z hlavných regulačných dejov v bunke a väčšina signálnych kaskád je sprostredkovaná práve fosforyláciu a defosforyláciou rady bielkovín. Fosforylované bielkoviny sa niekedy označujú pojmom fosfoproteíny.
Pod pojmom glykozylácia sa myslí napojenie sacharidových podjednotiek na polypeptidový reťazec a takto modifikované bielkoviny sa nazývajú glykoproteíny. N-glykozyláciou sa vytvára N-glykozidová väzba medzi uhlíkom sacharidu a dusíkom asparagínu, menej častou O-glykozyláciou sa vytvára O-glykozidová väzba medzi uhlíkom sacharidu a kyslíkom serínu alebo treonínu. Bielkoviny, v ktorých prevažuje sacharidová časť nad polypeptidovým reťazcom, sa nazývajú proteoglykány. Sacharidová časť predovšetkým zlepšuje rozpustnosť bielkovín vo vode, niekedy spôsobuje ich oligomerizáciu a často je bez nej znížená funkčnosť bielkoviny.
Ubikvitinilácia znamená naviazanie malej bielkoviny, ubikvitínu, na aminoskupinu lyzínu. Toto označenie ubikvitínom určuje vek bielkoviny, pričom ak počet ubikvitínov naviazaných na jednu bielkovinu prekročí isté množstvo, stáva sa ubikvitinilácia signálom pre degradáciu bielkoviny na proteazóme.
Ďalšími posttranslačnými modifikáciami sú metylácia, čiže prepojenie metylovej (CH3) skupiny na aminoskupinu lyzínu alebo arginínu; a acetylácia, čiže pripojenie acetylovej skupiny na aminoskupinu lyzínu. Metylácia a acetylácia sú častými úpravami histónov, ktoré regulujú ich asociáciu s DNA. Metylácia alebo acetylácia danej skupiny histónov môžu spôsobiť, že sa daný úsek DNA rozvoľní a stane sa prístupnejším pre transkripčné faktory.
Hydroxyláciou sa zavádza hydroxyskupina na molekuly lyzínu a prolínu, predovšetkým v bielkovine kolagén, ktorej hydroxylácia umožňuje vytvorenie jedinečnej sekundárnej štruktúry – trojitého helixu. Ďalšie posttranslačné modifikácie umožňujú ukotvenie (uchytenie) bielkovín na membráne. Ide o prenyláciu (pripojenie izoprenoidovej podjetnoky), myristiláciu (pripojenie kyseliny myristovej), palmitoyláciu (pripojenie kyseliny palmitovej) alebo pripojenie tzv. GPI (glykofosfatidylinozitolovej) kotvy. Zvláštnym typom posttranslačnej modifikácie je sumoylácia, čo je pripojenie proteínu SUMO1 na polypeptidový reťazec bielkoviny. Táto modifikácia má regulačnú funkciu. Regulačnú funkciu má tiež ADP-ribosylácia, čiže pripojenie ADP-ribózy na polypeptidový reťazec.
Ak je na bielkovinu pripojená nejaká iná skupina, ako jedna z už uvedených, ide o tzv. prostetickú skupinu. Typicky ide o ióny kovov, FAD (flavínadenínnukleotid) alebo hem. Ióny kovov niekedy spôsobujú farebnosť bielkovín – takáto bielkovina sa potom niekedy označuje ako chromoproteín.[5]
Proteínový obrat
[upraviť | upraviť zdroj]Termínom proteínový obrat (angl. protein turnover) sa myslí životný cyklus proteínov v bunke od ich syntézy, cez zbalovanie, posttranslačné modifikácie, pôsobenie v organizme, až po ich degradáciu. Všetky tieto procesy sú v bunke prísne regulované.[5]
Translácia
[upraviť | upraviť zdroj]Proteíny sú syntetizované procesom translácie, počas ktorého sú tvorené peptidové väzby medzi aminokyselinami v poradí, ktoré je predpísané genetickým kódom v molekule mRNA. Tento energeticky náročný proces je katalyzovaný obrovskými proteínovými komplexmi nazývanými ribozómy, ktoré sa môžu nachádzať buď voľne v cytoplazme alebo v prípade membránových proteínov na membráne endoplazmatického retikula (čím tvoria tzv. drsné endoplazmatické retikulum).[5]
Skladanie bielkovín
[upraviť | upraviť zdroj]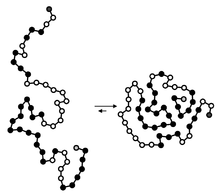
Pojmom folding sa označuje skladanie proteínov, čiže nadobudnutie ich natívnej konformácie. Tento proces prebieha kotranslačne, čiže počas translácie. Od počiatku translácie po ich zbalenie prebieha len veľmi krátky čas, napr. baktéria E. coli je schopná vytvoriť biologický aktívny 100 aminokyselín dlhý proteín pri 37 °C za 5 sekúnd. Taký čas je šokujúco krátky – ak by mohla každá aminokyselina zaujať 10 rôznych konformácii, celý proteín by mal 10100 rôznych možností konformácii. Ak by bola každá konformácia "odskúšaná" za najkratší možný čas (10−13 s, čo je čas jednej molekulovej vibrácie), trvalo by odskúšanie všetkých 1077 rokov (tzv. Levinthalov paradox), je teda jasné, že zbaľovanie proteínu neprebieha úplne náhodne. Iba menšina proteínov je zbalených spontánne, väčšina potrebuje pomoc od iných proteínov, tzv. chaperonov. Niektoré proteíny navyše potrebujú výpomoc od enzýmov proteín disulfid izomerázy (PDI), ktorá katalyzuje redistribúciu disulfidických mostíkov a peptidyl propyl cis-trans izomerázy (PPI), ktorá katalyzuje izomeráciu medzi cis a trans izomérmi prolínových aminokyselinových zvyškov.[5]
Degradácia bielkovín
[upraviť | upraviť zdroj]Zle zbalené, nefunkčné, poškodené a denaturované bielkoviny sú v bunke degradované pod prísnou reguláciou. Existujú dva hlavné degradačné systémy – obrovským proteínovým komplexom proteazómom, ktorý rozpoznáva ubiquitinylované proteíny a lyzozóm, čo je bunková organela s nižším pH prostredia a s účinnými proteázami.[5]
Denaturácia bielkovín
[upraviť | upraviť zdroj]Pod pojmom denaturácia sa myslí taká zmena trojdimenzionálnej štruktúry proteínu, ktorá vedie ku strate jeho funkcie. Väčšina proteínov môže byť denaturovaná zvýšenou teplotou, ktorá narúša slabé interakcie v molekule proteínu (predovšetkým vodíkové mostíky). Ide o kooperatívny proces – denaturácia jednej časti proteínu okamžite spôsobuje denaturáciu častí ostatných. Denaturácia nastáva aj extrémnou zmenou pH, niektorými rozpúšťadlami (etanol, acetón), denaturačnými činidlami (močovina, guanidín, hydrochloridy) a detergentmi. Ak je denaturácia ireverzibilná, často dochádza ku precipitácii (vyzrážaniu) proteínu. Za určitých podmienok môžu byť niektoré globulárne proteíny z denaturovaného stavu renaturované, a to ich navrátením do fyziologických podmienok.[5]
Dôkazy bielkovín
[upraviť | upraviť zdroj]Biuretova reakcia sa využíva na dôkaz peptidovej väzby -CO-NH-. Bielkoviny dávajú v alkalickom prostredí s iónmi Cu2+ farebný komplex. Intenzita zafarbenia závisí od molekulovej hmotnosti bielkoviny (polypeptidy – fialová, menšie peptidy – červená). Pozitívnu reakciu dáva aj biuret (NH2-CO-NH-CO-NH2) a niektoré aminokyseliny (His, Thr, Asn).
História poznania bielkovín
[upraviť | upraviť zdroj]
Záujem vedcov o molekuly, ktoré dnes nazývame bielkoviny, vzrástol vďaka ich spojeniu s procesmi potrebnými pre život. Už v roku 1789 rozlíšil francúzsky chemik Antoine Fourcroy tri varianty bielkovín živočíšneho pôvodu – albumín, fibrín a želatínu. Tieto molekuly boli súhrnne pomenované pojmom albumíny, podľa prototypu derivovaného z vaječného bielka (nemeckým ekvivalentom bol názov "Eiweisskörper"). Neskôr, v prvej polovici 19. storočia, kedy sa začali používať techniky elementárnej analýzy, boli identifikované základné prvky, z ktorých sa tieto molekuly skladajú: uhlík, vodík, kyslík, dusík, fosfor a síra. Hlavnú zásluhu v tejto oblasti nesie holandský chemik Gerrit Mulder, ktorý určil konštitutívny vzorec vaječného albumínu ako C400H620N100O120P1S1. Mulderov výskum zaujal aj jeho priateľa, švédskeho chemika Jacoba Berzelia, ktorý dal týmto molekulám názov proteíny, pochádzajúci z gréckeho πρώτειος (proteios, v preklade „vo vedení“, „číslo jeden“). Výsledky elementárnej analýzy však boli v tej dobe náročné na interpretáciu, aj pre to, že štvorväzbová povaha uhlíku bola objavená Augustom Kekuléom až neskôr v roku 1857. Navyše, molekuly s tak vysokou relatívnou molekulovou hmotnosťou v tej dobe neboli známe. Tento fakt bol hlavným bodom kritiky vtedy jedného z najuznávanejších vedcov, Justa Liebiga, ktorý tiež vyjadroval pochybovanie o čistote Mulderových vzoriek. Spory medzi Liebigom a Mulderom ale viedli ku zvýšenému záujmu vedeckej obce o štúdium bielkovín, vďaka čomu sa neskôr ich výskum zrýchlil.[29]
Významný posun v získavaní čistých vzoriek bielkovín nastal vďaka ich kryštalizácii, ktorá bola objavená náhodne na kvapkách vzorky krvi dážďoviek na povrchu skla v roku 1840. V druhej polovici 19. storočia bolo kryštalizovaných mnoho ďalších proteínov a k ich štúdiu prispeli predovšetkým spektroskopické techniky. Pomocou spektroskopie boli napríklad získané prvé funkčné informácie o bielkovine vôbec, konkrétne o hemoglobíne a prenose kyslíku, na základe jeho rozdielnych absorpčných spektier v oxidovanom a neoxidovanom stave.[29]
Štúdie však boli stále brzdené pre nedostatok vedomostí o chemickom zložení bielkovín. Za Muldera boli známe len dve aminokyseliny ako zložky bielkovín (leucín a glycín), do roku 1901 ich už ale bolo 17. Tieto znalosti využili Emil Fischer a Franz Hofmeister, ktorí ako prví objavili štruktúru peptidovej väzby, pričom svoje úplne nezávisle a inými metódami získané výsledky prezentovali v ten istý deň v roku 1902 na konferencii v Karlových varoch. Do roku 1936 boli objavené zvyšné tri proteinogénne aminokyseliny (ako posledný treonín) a so Sangerovým objavom sekvenácie bielkovín bolo možné zisťovať ich primárnu štrutúru. Určenie vyšších štruktúr bolo možné vďaka vzostupu metód röntgenovej kryštalografie. V roku 1958 tak bola zistená prvá bielkovinová štruktúra a to molekuly myoglobínu, za čo dostali v roku 1962 Max Ferdinand Perutz a Sir John Cowdery Kendrew Nobelovu cenu za chémiu. Vylepšenie metód proteínovej kryštalografie a zavedenie nových metód biochémie a molekulárnej biológie spôsobili obrovský nárast vedeckých publikácii a vedomostí o bielkovinách, ktorý trvá dodnes.[29][30]
Bielkoviny vo výžive
[upraviť | upraviť zdroj]Bielkoviny patria spolu s tukmi a sacharidmi medzi hlavné živiny, ktoré inými živinami nie je možné nahradiť. Pri trávení sú enzymaticky hydrolyzované na jednotlivé aminokyseliny, ktoré v organizme slúžia na stavbu vlastných bielkovín a na syntézu dusíkatých látok, predovšetkým porfyrínov a nukleozidov.[31]
Hlavným zdrojom bielkovín sú mäso, vajcia a mliečne produkty, nutrične dostačujúce sú však aj bielkoviny získané z rastlinnej stravy. Minimálna denná dávka pre dospelého človeka je 0,5 – 0,6 g na kilogram telesnej hmotnosti, odporúčaný príjem je 0,6 – 0,8 g na kilogram hmotnosti. Zvýšený príjem je odporúčaný v prípade detí a dojčiace matky. Na výstavbu tkanív (napr. svalov) výrazne zvýšený príjem nemá vplyv, keďže na kilogram telesnej hmotnosti je možné využiť najviac okolo 1,3 plnohodnotných bielkovín. Konkrétne až do výšky 1,6 – 2,2 gramu na kilogram hmotnosti.[31]
Pred trávením v organizme sú spravidla denaturované, ako tepelnou úpravou pred požitím, tak aj kyslým pH v žalúdku. Denaturáciou sa bielkoviny sprístupnia štiepiacim enzýmom – proteázam, čo je fyziologicky dôležité, na druhej strane môže byť tepelná denaturácia sprevádzaná reakciami znižujúcimi výživovú hodnotu bielkovín. Ide o deštrukciu termolabilných aminokyselín (napr. tryptofán alebo lyzín), ku vzniku xenobiotických aminokyselín a rôznych komplexov bielkovín s ostatnými zložkami potravy, ktoré sú odolné voči enzymatickému štiepeniu (typicky Maillardove reakcie).[31]
Trávenie prebieha ako postupná hydrolýza bielkovín proteázami v žalúdku a v tenkom čreve. V žalúdku štiepi bielkoviny proteáza pepsín na polypeptidy. Tie sú ďalej v tenkom čreve štiepené trypsínom a chymotrypsínom na oligopeptidy, na ktoré ďalej pôsobia karboxypeptidázy, aminopeptidázy a dipeptidázy. Aminokyseliny, dipeptidy a tripeptidy sú v tenkom čreve transportované do krvi alebo lymfy cez špeciálne receptory na povrchu epiteliálnych buniek tenkého čreva. Nevstrebané aminokyseliny sú metabolizované v hrubom čreve baktériami črevnej mikroflóry za vzniku odpadných produktov (sulfány, deriváty indolu).[31]
Pred nástupom moderných metód biochémie a molekulárnej biochémie sa na stanovenie výživovej hodnoty bielkovín používali biologické testy. Tie sa dnes používajú len v potravinárskej praxi. Najjednoduchším biologickým testom je PER test (z angl. Protein Efficiency Ratio), ktorý sa vyjadruje ako podiel zmeny hmotnosti pokusného zvieraťa a hmotnosti dodaných bielkovín. Inštrumentálne náročnejší je test NPU (z angl. Net Protein Utilization), v ktorom sa porovnáva množstvo dusíku v potrave a v tele zvieraťa kŕmeného s prídavkom danej bielkoviny a kontrolného zvieraťa. Ďalším testom je NPR test (Net Protein Retention), ktorý sa počíta ako podiel rozdielu zmien hmotností bielkovinou kŕmeného a kontrolného zvieraťa a hmotnosti bielkoviny. Najkomplexnejším je test BV (z angl. Biological Value), ktorý je podielom hodnoty testu NPU a tzv. tráviteľnosti, pričom tráviteľnosť sa počíta ako podiel dusíku využitého pre tvorbu proteínu a dusíku v potrave.[31]
Výskum bielkovín
[upraviť | upraviť zdroj]Výskumom proteínov sa zaoberajú predovšetkým biochémia a molekulárna biológia, proteíny sú však dôležité pre všetky biologické odbory. Príprava proteínov zahŕňa ich izoláciu, separáciu a purifikáciu, následný výskum sa týka ich štruktúry a funkcie.[5]
Preparácia
[upraviť | upraviť zdroj]Proteíny môžu byť pripravené buď rekombinantnými technikami molekulárnej biológie alebo môžu byť izolované z organizmov. Pri použití rekombinantných techník je potrebné navrhnúť gén pre daný proteín alebo časť proteínu, proteín naklonovať, následne vypestovať v bakteriálnych alebo kmeňových bunkových kultúrach a následne purifikovať. Klasickou metódou je izolácia proteínu z vybraného organizmu, pričom výber organizmu a orgánu izolácie je veľmi dôležitý pre výťažok. V oboch prípadoch sú používané podobné purifikačné techniky. Najprv sa spravidla uplatňujú fyzikálno-chemické javy ako rozpustnosť (vsolovanie a vysolovanie), stabilita (denaturácia zahrievaním, pH a činidlami), či difúzia (dialýza). Nasledujú metódy frakcionácie, zahŕňajúce typicky viacero druhov chromatografie, elektroforézu a prípadne blotovacie techniky.[5]
Funkčný výskum
[upraviť | upraviť zdroj]Prístupy výskumu funkcie proteínov sa líšia na základe ich funkcie. Typicky sa využívajú spektroskopické metódy (meranie enzýmovej kinetiky). Obrovské množstvo metód bolo vyvinutých pre meranie proteínových interakcií: Statický a dynamický rozptyl svetla, povrchová plazmónová rezonancia, fluorescenčná koleračná spektroskopia, FRET, izotermálna titračná kalorimetria, termoforéza, imunoprecipitácia, afinitná elektroforéza, SILAC, "phage-display", "yeast-two-hybrid system" a ďalšie.[5]
Štruktúrny výskum
[upraviť | upraviť zdroj]
Pre výskum absolútnej štruktúry proteínov boli vyvinuté tri základné techniky: röntgenová štruktúrna analýza, NMR a kryomikroskopia. Röntgenová štruktúrna analýza vyžaduje prípravu kryštálu proteínu, čo môže trvať aj roky skúšania rozličných kryštalizačných podmienok, na druhej strane ide o metódu pomerne lacnú a parametrami neobmedzenú. NMR je metóda drahšia, pretože vyžaduje prípravu izotopovo značených proteínov, navyše je v dnešnej dobe obmedzená veľkosťou proteínov (do relatívnej molekulovej hmotnosti 40 000). Zatiaľ čo predošlé dve metódy získať štruktúru v rozlíšení aj pod 1 Å, rozlíšenie dosiahnuteľné kryomikroskopiou je omnoho menšie a preto sa táto metóda používa predovšetkým na výskum veľkých proteínových komplexov.[5]
Čiastočné informácie o štruktúre proteínov je možné získať aj pomocou ďalších metód, akými sú hmotnostná spektrometria, povrchová plazmónová rezonancia, cirkulárny dichroizmus a mnoho ďalších.[5]
Poznámky
[upraviť | upraviť zdroj]- ↑ Ale výraz holoproteín sa alternatívne používa aj vo význame „celý zložený proteín vrátane prostetickej skupiny“.[15]
- ↑ Výraz štruktúrne bielkoviny sa alternatívne používa na označenie niektorých kontraktilných bielkovín, membránových bielkovín, bielkovín spoluvytvárajúcich ribozóm a pod.[21]
Referencie
[upraviť | upraviť zdroj]- ↑ PORÁČOVÁ, Janka; KORÉNEKOVÁ, Beáta; SEDLÁK, Vincent; KONEČNÁ, Mária. Základné zložky potravy a ich význam pre zdravie človeka. prvé. vyd. Prešov : Prešovská univerzita v Prešove, 2017. Dostupné online. ISBN 978-80-555-1839-8. S. 13.
- ↑ KOVÁČ, Jaroslav; KOVÁČ, Štefan. Organická chémia. 1. vyd. Alfa : Bratislava, 1977. (Edícia chemickej literatúry.) S. 798.
- ↑ proteíny. In: Malá encyklopédia chémie. 3. vyd. Bratislava : Obzor, 1981. 816 s. (Malé encyklopédie vydavateľstva Obzor.) S. 140.
- ↑ proteíny. Pyramída (Bratislava: Slovenský ústredný výbor Socialistickej akadémie ČSSR vo Vydavateľstve Obzor), január 1984, roč. XIII, čís. 151, s. 4818. ISSN 0231-9047.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae NELSON, David L.; COX, Michael M.. Lehninger Principles of Biochemistry. 6. vyd. New York : W. H. Freeman and Company, 2013. ISBN 978-1-4641-0962-1. (anglicky)
- ↑ a b DOBROTA, Dušan, a kol. Lekárska biochémia : vysokoškolská učebnica. 1. slov. vyd. Martin : Osveta, 2012. 723 s. ISBN 978-80-8063-293-9. S. 74.
- ↑ a b c Brockhaus-ABC Biologie Bd. 2. Me – Z. 6., überarb. u. erw. Aufl. Leipzig : Brockhaus, 1986. ISBN 3-325-00074-6. s. 717.
- ↑ a b c KODÍČEK, Milan. bílkoviny{1}. In: Biochemické pojmy : výkladový slovník [online]. Praha: VŠCHT, 2007, [cit. 2015-04-04]. Dostupné online.
- ↑ a b c KARCHER, Ruth ed. Proteine. In: Lexikon der Chemie. Heidelberg ; Berlin : Spektrum, Akad. Verl. [2003]. ISBN 3-8274-1148-3.
- ↑ a b Proteine. In: Lexikon der Biologie. München : Elsevier, Spektrum, Akad. Verl. ISBN 3-8274-0342-1. najmä Tab. 1
- ↑ a b c Chapter 10 Proteins Classification Archivované 2015-04-19 na Wayback Machine. In: Fundamentals Of Biochemistry [online]. Mohali, Punjab (INDIA): Chandigarh University, rev. 2014-03-21, [cit. 2015-04-04]. Dostupné online. Archivované 2015-04-19 z originálu.
- ↑ Brockhaus-ABC Biologie Bd. 2. Me – Z. 6., überarb. u. erw. Aufl. Leipzig : Brockhaus, 1986. ISBN 3-325-00074-6. s. 717, 173.
- ↑ heslá bielkovina a proteín in: Pyramída.
- ↑ a b c d e DOLEŽAL, Marek. Přednášky předmětu Chemie potravin [online]. [Cit. 2015-04-04]. Dostupné online.
- ↑ holoprotein [online]. Farlex, [cit. 2015-04-04]. Dostupné online.
- ↑ KOVÁČ, Jaroslav; KOVÁČ, Štefan. Organická chémia. 1. vyd. Alfa : Bratislava, 1977. (Edícia chemickej literatúry.)
- ↑ DEBAJYOTI, Das. Biochemistry. [s.l.] : Academic Publishers, 2010. Náhľad z Google books. Dostupné online. ISBN 978-93-80599-17-5.
- ↑ GURR, Edward. Methods of analytical histology and histo-chemistry. [s.l.] : Hill, 1958. Náhľad z Google books. Dostupné online.
- ↑ Proteine. In: Lexikon der Biologie. München : Elsevier, Spektrum, Akad. Verl. ISBN 3-8274-0342-1.
- ↑ KODÍČEK, Milan. bílkoviny – rozdělení podle funkce{1}. In: Biochemické pojmy : výkladový slovník [online]. Praha: VŠCHT, 2007, [cit. 2015-04-04]. Dostupné online.
- ↑ KODÍČEK, Milan. bílkoviny – strukturní motivy{1}. In: Biochemické pojmy : výkladový slovník [online]. Praha: VŠCHT, 2007, [cit. 2015-04-04]. Dostupné online.
- ↑ NOVÁKOVÁ, Iva. Zdravotní nauka : učebnice pro obor sociální činnost. 1. vyd. Praha : Grada, 2011. 187 s. Náhľad z Google books. Dostupné online. ISBN 978-80-247-3708-9. S. 32.
- ↑ LANGMEIER, Miloš, a kol. Základy lékařské fyziologie. 1. vyd. Praha : Grada, 2009. 320 s. Náhľad z Google books. Dostupné online. ISBN 978-80-247-2526-0. S. 160.
- ↑ Bielkoviny [online]. Biopedia.sk, [cit. 2022-01-18]. Dostupné online.
- ↑ Fvp:Proteid [online]. dai.fmph.uniba.sk, [cit. 2022-01-18]. Dostupné online.
- ↑ KOVÁČ, Jaroslav; KOVÁČ, Štefan. Organická chémia. 1. vyd. Alfa : Bratislava, 1977. (Edícia chemickej literatúry.) S. 798.
- ↑ proteín. In: Pyramída
- ↑ KARLIN, Samuel. Protein length in eukaryotic and prokaryotic proteomes. Nucleic Acids Res., 10. 6. 2005, s. 3390 – 3400. Dostupné online. DOI: 10.1093/nar/gki615. (anglicky)
- ↑ a b c TANFORD, Charles; REYNOLDS, Jacqueline. Nature's Robots: A history of proteins. 1. vyd. Oxford : Oxford, 2004. ISBN 978-0198606949. (anglicky)
- ↑ MARTZ, Eric. Earliest Solutions for Macromolecular Crystal Structures [online]. [Cit. 2015-04-11]. Dostupné online.
- ↑ a b c d e PÁNEK, Jan; POKORNÝ, Jan; DOSTÁLOVÁ, Jana. Základy výživy a výživová politika. 1. vyd. Praha : Vydavatelství VŠCHT Praha, 2002. ISBN 978-80-7080-468-1. (česky)
Iné projekty
[upraviť | upraviť zdroj] Commons ponúka multimediálne súbory na tému Bielkovina
Commons ponúka multimediálne súbory na tému Bielkovina


