Metán
| Metán | |||||||||||||||||||
 | |||||||||||||||||||
 | |||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||
| Sumárny vzorec | CH4 | ||||||||||||||||||
| Synonymá | bahenný plyn, zemný plyn, banský plyn, metylhydrid, ľahký uhľovodík | ||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||
| Molekulová hmotnosť | 16,04 g/mol | ||||||||||||||||||
| Teplota topenia | -182,5 °C /90,65 K | ||||||||||||||||||
| Teplota varu | -161,6 °C /111,55 K | ||||||||||||||||||
| Trojný bod | -182,48 °C 0,117 bar | ||||||||||||||||||
| Kritický bod | -82,6 °C 46 bar | ||||||||||||||||||
| Teplota vzplanutia | -188 °C | ||||||||||||||||||
| Medze výbušnosti | 5% - 15% | ||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||
| Skupenské teplo topenia | 1,1 kJ/mol | ||||||||||||||||||
| Skupenské teplo vyparovania | 8,17 kJ/mol | ||||||||||||||||||
| Štandardná zlučovacia entalpia | -74,87 kJ/mol | ||||||||||||||||||
| Štandardná entropia | 188 J/mol.K | ||||||||||||||||||
| Merná tepelná kapacita | 35,69 J/mol.K | ||||||||||||||||||
| |||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||
| Číslo CAS | 74-82-8 | ||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||
| Vlastnosti | NIST WebBook | ||||||||||||||||||
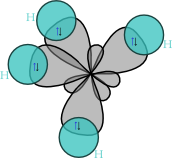
Metán (iné názvy: bahenný plyn, banský plyn, zemný plyn, ľahký uhľovodík [1], traskavý plyn[2], karbán [3], metylhydrid) je najjednoduchší uhľovodík. Je to pri bežných podmienkach bezfarebný plyn s chemickým vzorcom CH4. Čistý metán je bez zápachu, ale na komerčné účely sa zvykne zmiešavať s malým množstvom silno zapáchajúcich zlúčenín síry ako napríklad tetrahydrotiofén/THT/, ktoré mu dodávajú typický zápach, aby sa tak dali zistiť prípadné úniky. Metán tvorí podstatnú časť zemného plynu (až 97 %). Ako plyn vybuchuje v relatívne malom intervale koncentrácie so vzduchom (5 - 15 %).
Väzobné uhly v metáne majú veľkosť 109,5 stupňov. Spálenie jednej molekuly metánu za prítomnosti kyslíka uvoľní jednu molekulu oxidu uhličitého (CO2) a dve molekuly vody (H2O):
- CH4 + 2O2 → CO2 + 2H2O
Relatívne vysoký výskyt metánu a čisté spaľovania ho robia veľmi atraktívnym palivom. Avšak keďže za normálnych podmienok to je plyn, je ťažké ho prepravovať z miest, kde sa vyskytuje na miesta, kde je potrebný. Aktívny výskum sa venuje premene metánu na deriváty, ktoré sa dajú prepravovať ľahšie, ako napr. metanol. Niektoré mikroorganizmy nám v tejto selektívnej oxidácii môžu pomôcť produkciou enzýmov nazývaných metánové monooxigenázy.
Metán je relatívne potentný skleníkový plyn s vysokým potenciálom globálneho otepľovania (t. j. efekt globálneho otepľovania porovnaný s oxidom uhličitým).[4] Tretia hodnotiaca správa IPCC konštatuje, že v priemere za 100 ročné obdobie každý kilogram metánu oteplí Zem 25-krát viac ako rovnaké množstvo oxidu uhličitého. Štvrtá hodnotiaca správa sa už opravila berúc do úvahy i nepriame účinky a hovorí, že relatívny faktor otepľovania CH4 k CO2 v priemere za 20 rokov je až 72.[5] Dôvod tejto odlišnosť je fakt, že metán sa v atmosfére časom oxiduje na oxid uhličitý a vodu s polčasom rozpadu sedem rokov.
Doteraz sa odhaduje podiel metánu na globálnom otepľovaní asi na jednu tretinu efektu oxidu uhličitého. Je tu však veľké, doteraz neznáme, množstvo metánu vo forme metánového ľadu na oceánskom dne. Globálne otepľovanie by teoreticky mohlo tento metán uvoľniť, a tak spôsobiť ďalšie oteplenie. Podobné uvoľnenie metánu mohlo byť v minulosti príčinou veľkých vyhynutí na Zemi. Zemská kôra tiež obsahuje veľké množstvá metánu. Veľa metánu sa produkuje aj anaeróbne metánogenézou. Ďalšie zdroje zahŕňajú bahenné sopky spojené s hlbokými geologickými zlomami.
Chemické vlastnosti
[upraviť | upraviť zdroj]Hlavné chemické reakcie metánu sú: spaľovanie, reformovanie parou na vodný plyn a halogenácia. Vo všeobecnosti je ťažké udržiavať metánové reakcie pod kontrolou. Napríklad čiastočná oxidácia na metanol je ťažko uskutočniteľná, pretože rýchlo pokračuje ďalej až na oxid uhličitý a vodu.
Spaľovanie
[upraviť | upraviť zdroj]Spaľovanie metánu prebieha na niekoľko krokov:
Je veľmi pravdepodobné, že metán sa premieňa na formaldehyd (HCHO). Formaldehyd dáva formylový radikál (HCO-), ktorý sa následne rozpadá na oxid uhoľnatý (CO). Tento proces voláme oxidačná pyrolýza:
- CH4 + O2 → CO + H2 + H2O
Po pyrolýze sa H2 oxiduje na H2O a uvoľňuje sa teplo. Toto prebieha veľmi rýchlo, zvyčajne za menej ako jednu milisekundu.
- 2H2 + O2 →2H2O
Nakoniec sa CO oxiduje a vytvára tak CO2, čím sa uvoľňuje ďalšie teplo. Tento proces je už vo všeobecnosti pomalší ako ostatné kroky a vyžaduje niekoľko milisekúnd.
- 2CO + O2 →2CO2
Aktivácia vodíkom
[upraviť | upraviť zdroj]Sila kovalentnej väzby uhlík-vodík v metáne je jedna z najsilnejších vo všetkých uhľovodíkoch a teda použitie metánu ako chemickej suroviny je obmedzené. Napriek veľkej aktivačnej bariére na zlomenie väzby C-H je metán stále dôležitý počiatočný materiál pri výrobe vodíka reformovaním parou. Hľadania katalyzátora, ktorý by významne uľahčil aktiváciu väzieb C-H v metáne a iných nízkych alkánov je oblasť výskumu, ktorá má veľmi veľký priemyselný význam.
Reakcie s halogénmi
[upraviť | upraviť zdroj]Metán reaguje so všetkými halogénmi pri správnych podmienkach, ako napríklad:
- CH4 + X2 → CH3X + HX
kde X je halogén: fluór (F), chlór (Cl), bróm (Br) alebo jód (I). Mechanizmus v tomto procese sa nazýva halogenácia voľnými radikálmi.
Použitie
[upraviť | upraviť zdroj]Metán je hlavnou zložkou zemného plynu. Veľmi často sa používa priamo ako palivo. V porovnaní s ostatnými uhľovodíkmi počas horenia produkuje málo oxidu uhličitého. Hoci výhrevnosť metánu je 802 kJ/mol, čo je najmenej zo všetkých uhľovodíkov, keď sa prepočíta na hmotnosť (16 g/mol), vychádza metán ako najvýhrevnejší uhľovodík na jednotku hmotnosti. Ako zemný plyn sa v mnohých krajinách, vrátane Slovenska, privádza priamo v rúrach do domácností, kde sa spaľuje na vykurovanie a varenie.
Stlačený metán sa používa pod označením CNG (stlačený zemný plyn) aj ako palivo do automobilov. NASA skúma možnosti použitia metánu ako raketového paliva. Metán sa hojne nachádza v mnohých častiach Slnečnej sústavy a mohol by sa tak zozbierať priamo na mieste pristátia a poskytnúť palivo na cestu späť.
V chemickom priemysle sa metán používa ako surovina pri výrobe vodíka, metanolu, kyseliny octovej a anhydridu kyseliny octovej. Počas výroby týchto chemikálií sa najprv metán premieňa na vodný plyn (zmes oxidu uhoľnatého a vodíka) reformovaním parou. Reakcia metánu s vodnou parou prebieha za veľmi vysokých teplôt (700 – 1 100 °C) pri použití niklu ako katalyzátora:
- CH4 + H2O → CO + 3H2
Metán sa ďalej používa na výrobu acetylénu prechádzaním cez elektrický oblúk a chlórovaných derivátov (chlórmetán, dichlórmetán, chloroform a tetrachlórmetán) reakciou s chlórom. Tieto chemikálie sú však na ústupe, keďže acetylén je nahrádzaný lacnejšími a bezpečnejšími alternatívami a chlórmetány sú zdraviu škodlivé a nebezpečné pre životné prostredie.
Nedokonalým spaľovaním metánu vznikajú čierne sadze, ktoré sa pod názvom carbon black (uhľová čierna) používajú v gumárenskom priemysle ako farbivo a plnidlo.
Výroba
[upraviť | upraviť zdroj]Väčšinou sa získava zo zemného plynu, ale dá sa aj vyrobiť reakciou octanu sodného so suchým hydroxidom sodným:
- CH3COONa + NaOH → CH4 + Na2CO3
Referencie
[upraviť | upraviť zdroj]- ↑ metán. In: Malá encyklopédia chémie. 3. vydanie. Bratislava: Obzor, 1981. s. 452
- ↑ metan. In: BUJNÁK, Pavel, ed. Slovenský náučný slovník: Príručná encyklopédia vedomostí v troch dieloch 2. diel E – M. Bratislava, Praha: Litevna, literárne a vedecké nakladateľstvo Vojtech Tilkovský, 1932. s. 355
- ↑ http://www.e-chembook.eu/nazvoslovi-hydridu-reseni
- ↑ IPCC Third Assessment Report
- ↑ IPCC Fourth Assessment Report
Iné projekty
[upraviť | upraviť zdroj] Commons ponúka multimediálne súbory na tému Metán
Commons ponúka multimediálne súbory na tému Metán




