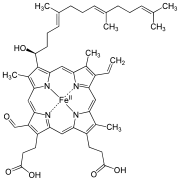
Hem A
| Hem A | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C49H56O6N4Fe |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 852,837 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 18535-39-2 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Hem A je druh hemu, čo je koordinačný komplex pozostávajúci z makrocyklického ligandu, patriaceho medzi porfyrín, ktorý cheluje atóm železa. Hem A je biomolekula, ktorá je prirodzene produkovaná mnohými organizmami. V roztoku má dichroicku zeleno-červenú farbu. Štruktúrne je podobný hemu B, ktorý je súčasťou hemoglobínu, červeného farbiva v krvi.
Vzťah k ostatným hemom
[upraviť | upraviť zdroj]Hem A sa líši od hemu B v tom, že metylová skupina na uhlíku 8 v kruhu je oxidovaná na formylovú skupinu a na vinylovú skupinu na uhlíku 2 je naviazaná hydroxyfarnezylová skupina, ktorá patrí medzi izoprenoidy. Hem A sa podobá na hem O, keďže obe majú farnezylovú skupinu na uhlíku 2, ale hem O nemá formylovú skupinu na uhlíku 8, namiesto ktorej má metylovú skupinu. Správna štruktúra hemu A, určená pomocou meraní NMR a IR spektroskopií, zistená pre redukované podobnu komplexu (s FeII), bola prvýkrát publikovaná v roku 1975.[1] Štruktúra bola potom potvrdená syntézou dimetylesteru hemu A bez atómu železa.[2]
História
[upraviť | upraviť zdroj]Hem A ako prvý izoloval nemecký biochemik Otto Warburg v roku 1951. Warburg takisto ukázal, že je to aktívna zložka integrálneho membránového metaloproteínu cytochróm c oxidázy.[3]
Stereochémia
[upraviť | upraviť zdroj]Poslednou otázkou v štruktúre hemu A bolo presné geometrické usporiadanie na prvom uhlíku na pozícii 3 v kruhu I, teda uhlíku viazanom na hydroxylovú skupinu. V roku 2005 bolo ukázané, že konfigurácia tohto chirálneho uhlíku je S.[4]
Podobne ako hem B, aj hem A je často naviazaný na apoproteín pomocou koordinačnej väzby medzi atómom železa a bočnými reťazcami zachovaných aminokyselín. V enzýme respiračného reťazca, cytochróm c oxidáze (CCO), je piatym ligandom hemu A, ktorý tvorí reakčné miesto pre kyslík, histidylová skupina.[5] Tento ligand (histidín) sa takisto bežne nachádza aj v iných hemoproteínoch, ako sú hemoglobín a myoglobín.

Ako kofaktor
[upraviť | upraviť zdroj]Príkladom metaloproteínu, ktorý viaže hem A, je cytochróm c oxidáza (CCO). Táto zložitá bielkovina obsahuje hem A na dvoch rôznych miestach, každý s inou finkciou. Jednotlivé miesta sú označované ako cytochróm a a cytochróm a3. Atóm železa v heme A v cytochróme a je hexakoordinovaný, teda viazaný na 6 ďalších atómov. V molekule cytochrómu a3 ja niekedy viazaný na 5 iných atómov (pentakoordinácia), čo necháva voľné šieste väzbové miesto, kam sa môže viazať molekula kyslíku (O2).[6] Okrem toho tento enzým viaže tri ióny mede, horčík, zinok a niekoľko iónov sodíka a draslíka. Predpokladá sa, že tieto dve hemové skupiny si vymieňajú elektróny medzi sebou, iónmi mede a proteínom cytochrómom c poblíž.
Predpokladá sa, že formylová skupina a izoprenoidový bočný reťazec majú v CCO dôležitú úlohu v zachovávaní energie pri redukcii kyslíka. CCO je podľa všetkého zodpovedaná za zachovávanie energie redukcie dikyslíku tým, že pumpuje protóny do intermembránového priestoru mitochondrie. Tento predpoklad bol publikovaný skupinou S. Yoshikawovej.[7]
Referencie
[upraviť | upraviť zdroj]- ↑ Heme A of Cytochrome c Oxidase. Journal of Biological Chemistry, 1975, s. 7602–7622. DOI: 10.1016/S0021-9258(19)40860-0. PMID 170266.
- ↑ Isolation, crystallisation, and synthesis of the dimethyl ester of porphyrin a, the iron-free prosthetic group of cytochrome c oxidase. Journal of the Chemical Society, Perkin Transactions 1, 1985, s. 135. DOI: 10.1039/P19850000135.
- ↑ Cytohämin aus Herzmuskel. Zeitschrift für Physiologische Chemie, 1951, s. 1–4. DOI: 10.1515/bchm2.1951.288.1.1. PMID 14860765.
- ↑ Yamashita E, Aoyama H, Yao M, Muramoto K, Shinzawa-Itoh K, Yoshikawa S, Tsukihara T.; AOYAMA; YAO. Absolute configuration of the hydroxyfarnesylethyl group of heme A, determined by X-ray structural analysis of bovine heart cytochrome c oxidase using methods applicable at 2.8 Angstrom resolution. Acta Crystallographica D, 2005, s. 1373–1377. DOI: 10.1107/S0907444905023358. PMID 16204889.
- ↑ Tsukihara T, Shimokata K, Katayama Y, Shimada H, Muramoto K, Aoyama H, Mochizuki M, Shinzawa-Itoh K, Yamashita E, Yao M, Ishimura Y, Yoshikawa S.; SHIMOKATA; KATAYAMA. The low-spin heme of cytochrome c oxidase as the driving element of the proton-pumping process. PNAS, 2003, s. 15304–15309. DOI: 10.1073/pnas.2635097100. PMID 14673090.
- ↑ a b Redox-Coupled Crystal Structural Changes in Bovine Heart Cytochrome c Oxidase. Science, 1998, s. 1723–1729. Dostupné online. DOI: 10.1126/science.280.5370.1723. PMID 9624044.
- ↑ Shimokata K, Katayama Y, Murayama H, Suematsu M, Tsukihara T, Muramoto K, Aoyama H, Yoshikawa S, Shimada H.; KATAYAMA; MURAYAMA. The proton pumping pathway of bovine heart cytochrome c oxidase. PNAS, 2007, s. 4200–4205. DOI: 10.1073/pnas.0611627104. PMID 17360500.
Pozri aj
[upraviť | upraviť zdroj]Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Heme A na anglickej Wikipédii.
