Mravčan amónny
| Tomuto článku alebo sekcii chýbajú odkazy na spoľahlivé zdroje, môže preto obsahovať informácie, ktoré je potrebné ešte overiť. Pomôžte Wikipédii a doplňte do článku citácie, odkazy na spoľahlivé zdroje. |
| Mravčan amónny | |||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||
| Sumárny vzorec | NH4HCO2 | ||||||||||||||||||||||||||||||||
| Vzhľad | Biely hygroskopický prášok | ||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 63,1 u | ||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 63,0559 g/mol | ||||||||||||||||||||||||||||||||
| Teplota topenia | 116 °C | ||||||||||||||||||||||||||||||||
| Teplota rozkladu | 180 °C | ||||||||||||||||||||||||||||||||
| Hustota | 1.280 g/cm³ | ||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: 102 g/100 ml (0 °C) 143 g/100 ml (20 °C) 531 g/100 ml (80 °C) v polárnych rozpúšťadlách: kvapalný amoniak alkohol dietyléter | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||
| Číslo CAS | 540-69-2 | ||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||
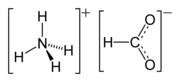
Mravčan amónny (NH4HCO2) je amónna soľ kyseliny mravčej. Je to bezfarebná, hygroskopická, kryštalická pevná látka.
Použitie
[upraviť | upraviť zdroj]Čistý mravčan amónny sa rozkladá na formamid a vodu. Kyselinu mravčiu je možno získať reakciou mravčanu amónneho so zriedenou kyselinou a pretože mravčan amónny sa tiež vyrába z kyseliny mravčej, môže slúžiť ako spôsob uloženia kyseliny mravčej.
V prítomnosti paládia sa mravčan amónny rozkladá na vodík, oxid uhličitý a na amoniak. Vodík adsorbuje na povrch kovového paládia, kde môže reagovať s rôznymi funkčnými skupinami. Napríklad alkény môžu byť adované na alkány, alebo formaldehyd na metanol. Aktivované jednoduché väzby na heteroatómy a tiež môžu byť nahradené atómami vodíka (hydrogenácia).
Mravčan amónny môže byť použitý v Leuckartovej reakcii. Môže sa tiež použiť ako vyrovnávacia pamäť v kvapalinovej chromatografii (HP-LC), a je vhodný pre použitie v hmotnostnej spektrometrii s kvapalinovou chromatografiou ( LC/MS). Hodnoty kyslej disociačnej konštanty kyseliny mravčej a amónneho iónu sú 3,8 a 9,2.
Reakcia
[upraviť | upraviť zdroj]Pri zahriatí mravčanu amónneho sa odstraňuje voda, tvorí sa formamid. Pri ďalšom zahrievaní sa tvorí amoniak a voda.
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Ammonium formate na anglickej Wikipédii.



