Alkén
| Tomuto článku alebo sekcii chýbajú odkazy na spoľahlivé zdroje, môže preto obsahovať informácie, ktoré je potrebné ešte overiť. Pomôžte Wikipédii a doplňte do článku citácie, odkazy na spoľahlivé zdroje. |
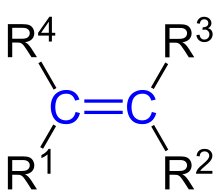
Alkény sú nenasýtené uhľovodíky s dvojitou väzbou v reťazci. uhlíka spojené dvojitou väzbou majú sp2 hybridizáciu.
Názvy
[upraviť | upraviť zdroj]Alkény sa nazývajú aj alkylény alebo olefíny alebo olefinické uhľovodíky. Triviálny názov olefín pochádza z francúzštiny, pretože reakciou eténu s brómom vzniká olejovitý dibromid, ktorý nazvali gas olefaint, teda v preklade olejotvorný plyn.
Dvojitá väzba a jej charakteristika
[upraviť | upraviť zdroj]Väzby, ktoré vychádzajú z atómov uhlíka v hybridizácii sp2, majú väzbový uhol 120° (2/3 π rad), preto ležia v jednej rovine. Dvojitá väzba bráni voľnej rotácii, čo umožňuje vznik stereoizomérov. Na uhlíkovom reťazci alkénov, kde sú jednoduché väzby medzi atómami uhlíka, vzniká štruktúrna izoméria. Prekrytie orbitálov p vo väzbe pí je menšie, preto aj jej energia je nižšia než u sigma väzby. Dvojitá väzba C=C je kratšia (134 pm) ako jednoduchá väzba C-C (154 pm), preto je aj pevnejšia. Dvojitá väzba sa u alkénov skladá z jednej pí a jednej sigma kovalentnej väzby.
Názvoslovie
[upraviť | upraviť zdroj]Systémové názvy alkénov sú odvodené z alkánov výmenou prípony -án za -én. Pri alkénoch existuje izoméria polohy násobnej väzby, preto sa jej poloha označuje lokantom pred príponou -én a počet dvojitých väzieb charakteristickou predponou podobne ako u alkínov. Tieto predpony sú uvedené nižšie:
| Počet | Predpona |
|---|---|
| 1 | mono |
| 2 | di |
| 3 | tri |
| 4 | tetra |
| 5 | penta |
| 6 | hexa |
| 7 | hepta |
| 8 | okta |
| 9 | nona |
| 10 | deka |
| 11 | undeka |
| 12 | dodeka |
| 20 | ikoza |
| 30 | triakonta |
| 100 | hekta |
| 200 | dikta |
| 1000 | kilia |
| 2000 | dilia |
Homologický rad a všeobecné vzorce
[upraviť | upraviť zdroj]Homologický rad závisí od všeobecného vzorca pre daný alkén. Všeobecné vzorce sú uvedené nižšie.
| Počet dvojitých väzieb | Vzorec |
|---|---|
| 1 | CnH2n |
| 2 | CnH2n-2 |
| 3 | CnH2n-4 |
| 4 | CnH2n-6 |
| 5 | CnH2n-8 |
Zástupcovia
[upraviť | upraviť zdroj]Etén (etylén) je ľahký bezfarebný plyn sladkastej vône. Je horľavý a v určitom pomere so vzduchom výbušný. Získava sa pri chemickom spracovaní niektorých frakcií ropy. Patrí medzi najvýznamnejšie suroviny v modernej technológii. Vyrába sa z neho napríklad polyetylén (PE), etanol (C2H5OH), vinylchlorid (CH2=CHCl), rozpúšťadlá s Cl a v jeho prítomnosti rýchlo dozrieva ovocie (funguje ako hormón dozrievania).
Propén (propylén) je plynná látka, ktorá sa, podobne ako etén, vyrába z ropy. Používa sa hlavne na výrobu polypropylénu (PP), acetónu (CH3-CO-CH3), kuménu a ďalších organických látok.
Klasifikácia
[upraviť | upraviť zdroj]Alkény s viacerými dvojitými väzbami sa skrátene nazývajú diény, triény, ..., polyény. Podľa toho, ako sú viaceré dvojité väzby v reťazci usporiadané, sa delia na:
- Kumulované - 2-ité väzby vychadzajú z 1 uhlíka.
- Konjugované - medzi každými dvoma 2-itými väzbami je 1 jednoduchá väzba.
- izolované - medzi 2-tými väzbami sú najmenej 2 jednoduché väzby.
Vznik a príprava
[upraviť | upraviť zdroj]- CH3-CH2-CHX-CH3 → CH3-CH=CH-CH3 + HX
- z 1,2-dihalogénuhľovodíkov elimináciou:
- CH3-CHX-CHX-CH3 → CH3-CH=CH-CH3 + X2
- CH3-CH2-CHOH-CH3 → CH3-CH=CH-CH3 + H2O
- CH3-CH2-CH2-CH3 → CH3-CH=CH-CH3 + H2
Reakcie
[upraviť | upraviť zdroj]- Adícia
- elektrofilná - potrebné elektrofilné činidlo
- radikálová - prebieha za vzniku radikálov
- cis adícia (označovaná aj ako Z-adícia) - pri vzniknutých derivátoch charakteristické skupiny ležia v 1 rovine
- Oxoreakcia - reakcia s CO, H2O, H2
- Polymerizácia -vznikajú polyméry, teda plasty
- Substitúcia - dochádza k nahradzovaniou vodíka charakteristickou skupinou
