Chlorid chromitý
| Chlorid chromitý | |||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||
 | |||||||||||||||||||||||||||||||||
| Všeobecné vlastnosti | |||||||||||||||||||||||||||||||||
| Sumárny vzorec | CrCl3 | ||||||||||||||||||||||||||||||||
| Vzhľad | fialový prášok (bezvodný) tmavozelené, zelené alebo fialové kryštály (hexahydrát) | ||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti | |||||||||||||||||||||||||||||||||
| Molekulová hmotnosť | 158,4 u (bezvodný) 266,5 u (hexahydrát) | ||||||||||||||||||||||||||||||||
| Molárna hmotnosť | 158,355 g/mol (bezvodný) 266,48 g/mol (hexahydrát) | ||||||||||||||||||||||||||||||||
| Teplota topenia | 1 150 °C (pri zvýšenom tlaku) 83 °C (hexahydrát) | ||||||||||||||||||||||||||||||||
| Teplota rozkladu | 1 300 °C | ||||||||||||||||||||||||||||||||
| Hustota | 2,915 6 g/cm³ (bezvodný) 1,760 g/cm³ (hexahydrát) | ||||||||||||||||||||||||||||||||
| Rozpustnosť | vo vode: takmer nerozpustný v polárnych rozpúšťadlách: Metanol Dietyléter Acetón | ||||||||||||||||||||||||||||||||
| Termochemické vlastnosti | |||||||||||||||||||||||||||||||||
| Štandardná zlučovacia entalpia | -563,3 kJ/mol | ||||||||||||||||||||||||||||||||
| Štandardná entropia | 125,6 J K-1 mol-1 | ||||||||||||||||||||||||||||||||
| Štandardná Gibbsová energia | -493,8 kJ/mol | ||||||||||||||||||||||||||||||||
| Merná tepelná kapacita | 0,580 J K-1 g-1 | ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
| Ďalšie informácie | |||||||||||||||||||||||||||||||||
| Číslo CAS | 10025-73-7 10060-12-5 (hexahydrát) | ||||||||||||||||||||||||||||||||
| EINECS číslo | 233-038-3 | ||||||||||||||||||||||||||||||||
| Číslo RTECS | GB5425000 | ||||||||||||||||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |||||||||||||||||||||||||||||||||
Chlorid chromitý (CrCl3) tvorí v bezvodom stave červenofialové (broskyňovo) lesklé lístočky, ktoré možno pri červenom svetle v prúde chlóru prečisťovať sublimáciou. Bez prítomnosti chlóru dochádza k čiastočnému rozkladu na chlorid chromnatý a chlór. Vo vode a etanole sa rozpúšťa veľmi obmedzene a to aj za varu. Rozpúšťa sa však, ak je v kvapaline prítomné aspoň malé množstvo chloridu chromnatého a to dokonca za uvoľňovania tepla (vzniká tmavozelený roztok hexahydrátu). Rozpustnejší je ďalej aj bez pridania chloridu chromnatého v metanole, dietyléteri a acetóne. Má sladkastú chuť. Hydráty majú zložitejšiu komplexnú povahu a ich štruktúra je podrobnejšie popísaná nižšie.
Hydráty chloridu chromitého
[upraviť | upraviť zdroj]
Z vodného roztoku kryštalizuje tmavozelený hexahydrát chloridu chromitého CrCl3 • 6 H2O, ktorý má oktaedrické ligandové pole okolo centrálneho atómu Cr3+. Zráža sa reakciou s dusičnanom strieborným podľa stechiometrickej reakcie zrazí len jeden z prítomných chloridových aniónov, čo znamená, že zvyšné 2 musia byť vo zlúčenine viazané komplexne. Štruktúrne správny zápis vzorca vystihuje preto tvar [Cr(H2O)4Cl2]Cl • 2 H2O, systematicky sa táto zlúčenina potom nazýva dihydrát chloridu tetraaqua-dichloridochromitého. Okrem tejto zlúčeniny, ktorú možno považovať za hexahydrát chloridu chromitého, existujú však aj jej ďalšie 2 hydrátové izoméry.
Existuje ďalej zelená zlúčenina so vzorcom [Cr(H2O)5Cl]Cl2 • H2O (hydrát dichloridu pentaaqua-chloridochromitého) a sivomodrý [Cr(H2O)6]Cl3 (trichlorid hexaaquachromitý). Rozlíšenie týchto zlúčenín od seba sa vykonáva už vyššie spomenutým zrážaním s dusičnanom strieborným a podľa množstva zrazeného chloridu strieborného je možné zo stechiometrickej rovnice jednoducho vypočítať, o ktorý z týchto hydrátov ide:
- [Cr(H2O)4Cl2]Cl + 3 AgNO3 → [Cr(H2O)4Cl2]NO3 + 2 AgNO3 + AgCl↓
- [Cr(H2O)5Cl]Cl2 + 3 AgNO3 → [Cr(H2O)5Cl](NO3)2 + AgNO3 + 2 AgCl↓
- [Cr(H2O)6]Cl3 + 3 AgNO3 → [Cr(H2O)6](NO3)3 + 3 AgCl↓
Ak sa nechá chlorid chromitý kryštalizovať z roztokov ochladzovaných pod 6 °C, tak z nich kryštalizuje v podobe dekahydrátu chloridu chromitého CrCl3 • 10 H2O.
Príprava
[upraviť | upraviť zdroj]V bezvodom stave je možné chlorid chromitý pripraviť vedením suchého chlóru cez kovový chróm zahriaty do červeného žiaru. Jedná sa síce o exotermickú reakciu, tá však neprodukuje toľko tepla, aby sa následne sama udržala v chode:
- 2 Cr + 3 Cl2 → 2 CrCl3
Ďalším spôsobom prípravy je vedenie suchého chlóru cez zmes oxidu chromitého Cr2O3 a uhlie zahriatych k žiaru:
- Cr2O3 + 3 C + 3 Cl2 → 2 CrCl3 + 3 CO
Ďalšou možnosťou je zahrievanie oxidu chromitého s chloridom uhličitým CCl4 alebo dichloridom disírnatým S2Cl2:
- Cr2O3 + 3 CCl4 → 2 CrCl3 + COCl2
- 2 Cr2O3 + 6 S2Cl2 + 9 O2 → 4 CrCl3 + 12 SO2
Reakcia a použitie
[upraviť | upraviť zdroj]Bezvodý chlorid chromitý reaguje s inými zlúčeninami za vzniku ďalších chromitých zlúčenín. Žíhaním na vzduchu prechádza do zeleného oxidu chromitého. Pôsobením sírovodíka H2S, amoniaku NH3 alebo fosfánu PH3 za žiaru ho možno previesť na zlúčeniny s príslušným aniónom.
- 4 CrCl3 + 3 O2 → 2 Cr2O3 + 6 Cl2
- 2 CrCl3 + 3 H2S → Cr2S3 + 6 HCl
- CrCl3 + NH3 → CrN + 3 HCl
- CrCl3 + PH3 → CrP + 3 HCl
Chlorid chromitý je Lewisovou kyselinou, ktorá patrí tzv. tvrdé kyseliny a tvorí veľmi často zlúčeniny typu [CrCl3L3], kde L je Lewisova báza. Napríklad reakciou s pyridínom vzniká adukt:
- CrCl3 + 3 C5H5N → [CrCl3(C5H5N)3]
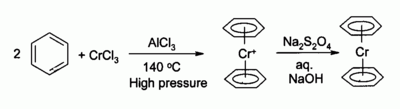
S roztavenými chloridmi alkalických kovov, ako napríklad chloridom draselným, dáva chlorid chromitý oktaedrické komplexy typu hexachloridochromitanu draselného K3[CrCl6] alebo pri väčšom množstve chloridu chromitého dáva nonachloridochromitan draselný CrCl3K3[Cr2Cl9], ktorý je tiež oktaedrický, ale v ktorom sú 2 atómy chrómu spojené cez 3 atómy chlóru mostíkovou väzbou. Chlorid chromitý sa používa ako prekurzor pre veľké množstvo zlúčenín, napríklad bis(benzén)chrómu, analóg ferocénu:
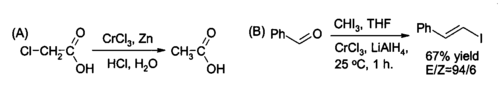
Jedno z použití chloridu chromitého v organickej syntéze je jeho redukcia na chlorid chromnatý CrCl2 priamo v reakčnej zmesi a používa sa ako činidlo na (A) redukciu alkyl halogenidov a (B) syntézu (trans)-alkenyl halogenidov. Reakcia sa zvyčajne vykonáva pomocou dvoch molov chloridu chromitého na mol tetrahydridohlinitanu lítneho Li[AlH4], aj keď v prípade vodného roztoku stačí zinok a kyselina chlorovodíková.
Chlorid chromitý sa ako Lewisova kyselina takisto využíva na katalýzu nitrózo Diels-Alderových reakcií.
Podobné látky
[upraviť | upraviť zdroj]- Bromid chromitý
- Fluorid chromitý
- Jodid chromitý
- Chlorid chromičitý
- Chlorid chrómnatý
- Chlorid molybdénitý
- Chlorid volfrámitý
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Chlorid chromitý na českej Wikipédii.
Literatúra
[upraviť | upraviť zdroj]- VOHLÍDAL, Jiří; ŠTULÍK, Karel; JULÁK, Alois. Chemické a analytické tabuľky. 1. vyd. Praha : Grada Publishing, 1999. ISBN 80-7169-855-5.
- Dr. Heinrich Remy, Anorganická chémia, 2. diel. Preklad Milan Drátovský, Zdeněk Hauptman, Jiří Hejduk, Vladimír Machálek, Lieselotta Pačesová. 1. vyd. Praha : SNTL, 1961. (český)




![[Cr(H2O)6]Cl3](http://upload.wikimedia.org/wikipedia/commons/thumb/d/da/-Cr%28H2O%296-Cl3.JPG/250px--Cr%28H2O%296-Cl3.JPG)
![[Cr(H2O)5Cl]Cl2.H2O](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b7/-Cr%28H2O%295Cl-Cl2.H2O.jpg/250px--Cr%28H2O%295Cl-Cl2.H2O.jpg)
![[Cr(H2O)4Cl2]Cl.2H2O](http://upload.wikimedia.org/wikipedia/commons/thumb/a/a4/-Cr%28H2O%294Cl2-Cl.2H2O.jpg/250px--Cr%28H2O%294Cl2-Cl.2H2O.jpg)