Bór
| Bór (borum) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhľad | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| hnedočierna tuhá látka | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atómové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atómová hmotnosť | 10,811 g·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrónová konfigurácia | [He] 2s2 2p1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atómový polomer | 85 pm (vyp.: 87 pm) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentný polomer | 82 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita | 2,04 (podľa Paulinga) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizačná energia(e) | 1: 800,6 kJ.mol−1 2: 2 427,1 kJ.mol−1 3: 3 659,7 kJ.mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidačné číslo(a) | -III, I, II, III | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti (za norm. podmienok) všetky údaje sa vzťahujú na tetragonálny bór | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenstvo | pevné | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hustota | 2,34 kg·dm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota topenia | 2 349 K (2 075,85 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota varu | 4 200 K (3 926,85 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sk. teplo topenia | 480 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sk. teplo varu | 50,2 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná kapacita | 11,87 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kryštálová sústava | tetragonálna, rombická | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizmus | diamagnetický | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrický odpor | 15 000 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tep. vodivosť | 27,4 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tep. rozťažnosť | 5 µm·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rýchl. zvuku | 16 200 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Objemová pružnosť | 185 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tvrdosť (Mohs) | 9,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reg. číslo CAS | 7440-42-8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotop(y) (vybrané) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Bór (lat. borum) je chemický prvok v periodickej tabuľke prvkov, ktorý má značku B a protónové číslo 5. Patrí medzi polokovové prvky (ako jediný prvok z 13. skupiny) a vyskytuje sa v dvoch modifikáciách, ako amorfný a kryštalický. Kryštalický bór je veľmi tvrdý, po uhlíku (diamante) je to druhý najtvrdší prvok periodickej tabuľky. Elektrónová konfigurácia atómu bóru je 1s2 2s2 2p1, v zlúčeninách sa vyskytuje väčšinou v oxidačnom stupni 3. Bór a jeho zlúčeniny intenzívne sfarbujú plameň dozelena. Tento jav sa využíva na prípravu zmesí pre pyrotechnické účely a v analytickej chémii slúži ako dôkaz prítomnosti bóru v analyzovanej vzorke.
História
[upraviť | upraviť zdroj]Bór bol prvýkrát izolovaný v roku 1808 sirom Humphrym Davyom, Josephom Gay-Lussacom a Louisom Thénardom v neveľmi vysokej čistote, ale až v roku 1824 ho Jakob Berzelius označil za samostatný prvok.
Vlastnosti
[upraviť | upraviť zdroj]Fyzikálne vlastnosti
[upraviť | upraviť zdroj]Bór sa vyskytuje v troch modifikáciách, základom ich štruktúry je ikosaéder B12. Atómy bóru sú v ikozaédri pospájané so susedmi piatimi delokalizovanými väzbami. Jednotlivé modifikácie sa líšia usporiadaním ikozaédrov v kryštálovej štruktúre, prípadne aj prítomnosťou iných zoskupení (B6, B10), prípadne aj prítomnosťou jednotlivých atómov bóru.
Najznámejší je tetragonálny bór, ktorý je mimoriadne tvrdý a má vysoké teploty topenia a varu. Má sivočiernu farbu a kovový lesk. Amorfný bór je hnedá práškovitá tuhá látka, ktorej hustota je nižšia ako hustota kryštalickej formy.
Chemické vlastnosti
[upraviť | upraviť zdroj]Kryštalický bór takmer nereaguje, amorfný je reaktívnejší, pri zvýšenej teplote reaguje s kyslíkom, dusíkom, halogénmi a sírou za vzniku príslušných binárnych zlúčenín. Oxiduje sa aj s kyselinou dusičnou a za tepla aj s koncentrovanou kyselinou sírovou. Tavením s hydroxidmi poskytuje boritany.
Spôsob väzby
[upraviť | upraviť zdroj]V zlúčeninách sa vyskytuje v oxidačnom stupni 3, no známe sú aj zlúčeniny s oxidačnými stupňami 2 a 1 (napr B2Cl4, B4Cl4). Väzba je poväčšine polárna, iónová väzba je vzhľadom na vysoké ionizačné energie nereálna. Nepolárne väzby sa vyskytujú v elementárnom bóre, ako aj vo viacerých boránoch a boridoch. Bór nemá veľký počet valenčných elektrónov, preto často vytvára delokalizované, elektrónovo deficitné väzby. Takéto väzby sa vyskytujú jednak v elementárnom bóre, v boránoch, ich derivátoch a v hydridoboritanoch.
V hybridnom stave SP2, ktorý je pre bór tiež častý, vytvára tri σ-väzby, ležiace v rovine a zvierajúce uhol 120 °. Orbitál 2pz je voľný a môže sa prekrývať s obsadenými 2pz orbitálmi väzbových partnerov za vzniku delokalizovanej π-väzby (napr v halogenidoch boritých). V cyklických zlúčeninách ako borazol existujú aj π-väzby benzénového typu.
V halogenidoch, kde nie sú atómy bóru dostatočne elektrónovo nasýtené, často nastáva prechod z SP2 hybridného stavu na SP3, pričom vzniká tetraedrický komplex, kde je dosiahnutá maximálna väzbovosť štyroch σ-väzieb (napr. BF4−, BH4−).
Izotopy
[upraviť | upraviť zdroj]bór sa v prírode vyskytuje v dvoch stabilných izotopoch, 11B (80,1 %) a 10B (19,9 %). Známych je aj ďalších 12 nestabilných izotopov, z nich má najmenší polčas rozpadu 7B – len 3,5×10−22 s. Zaujímavosťou je diferenciácia stabilných izotopov vo vodnom roztoku, keď 11B zostáva v roztoku a 10B prechádza do tuhej fázy. Preto má napr. morská voda vyšší obsah 11B.
Zlúčeniny
[upraviť | upraviť zdroj]Binárne zlúčeniny
[upraviť | upraviť zdroj]Borány
[upraviť | upraviť zdroj]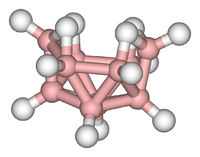
Borány (alebo borovodíky) sú binárne zlúčeniny bóru s vodíkom. Tvoria, podobne ako uhľovodíky, väčšiu skupinu látok, no na rozdiel od nich sa v boránoch nevyskytujú dlhšie reťazce B-B, ale skôr trojuholníkové zoskupenia, tvorené atómami bóru. Každý atóm takéhoto zoskupenia môže byť zároveň aj členom iného zoskupenia. Atóm bóru sa tak môže chemicky viazať až so šiestimi inými atómami, no na štyri väzbové orbitály má len tri elektróny. Preto sú pre borány charakteristické delokalizované, elektrónovo deficitné väzby, s dvoma, až troma centrami. Rozdeľujú sa podľa štruktúry na nido- (otvorený skelet) a kloso- (uzavretý skelet) borány. Borány majú vďaka špecifickosti reakcií význam v organickej syntéze.
Borány s menším počtom atómov bóru (diborán a tetraborán) sú plynné, ostatné sú kvapalné. Niektoré borány sú opticky aktívne. Diborán sa pripravuje syntézou:
- 3 LiAlH4 + 7 BF3(C2H5)2O → 2 B2H6 + 3 LiBF4 + 3 AlF3 + 7 (C2H5)2O
Viaceré vyššie borány sa vyskytujú v zmesi, ktorá vzniká reakciou zriedenej kyseliny chlorovodíkovej s diboridom horčíka, prípadne sa pripravujú z diboránu. Celkovo je v súčasnoti známych približne dvadsať boránov.
Borány sú veľmi reaktívne látky, viaceré sa na vzduchu samozapaľujú a zhoria na oxid boritý a vodu. Taktiež sa ľahko rozkladajú vo vodnom prostredí.
- B2H6 + 6 H2O → 2 H3BO3 + 6 H2
Odtrhnutím jedného alebo viacerých vodíkových katiónov z molekuly boránu vznikaju hydroboráty, ktoré sú stálejšie ako príslušné borány. Najjednoduchší z nich je tetrahydridoboritan (BH4−), ktorý dokonca vytvára iónové zlúčeniny.
- 2 LiH + B2H6 → 2 LiBH4
Boridy
[upraviť | upraviť zdroj]Boridy sú zlúčeniny bóru s menej elektronegatívnymi prvkami, najčastejšie s kovmi. V ich štruktúre sa často vyskytujú izolované atómy bóru, prípadne sú reťazcovo pospájané, alebo vytvárajú trojrozmerné skelety B6, B12. Väzby v takýchto zlúčeninách sú viaccentrové. Boridy sú veľmi tvrdé, majú vysoké teploty topenia a sú vo všeobecnosti nereaktívne. Niektoré (borid zirkónu ZrB2 a titánu TiB2) majú mnohonásobne vyššiu tepelnú a elektrickú vodivosť ako samotné kovy a viaceré sú polovodivé.
Halogenidy
[upraviť | upraviť zdroj]
Z halogenidov bóru sú známe zlúčeniny typu BX3 a B2X4. Molekula BX3 má trojuholníkový tvar s atómom bóru v strede, halogenidovými aniónmi vo vrcholoch a delokalizovanou π-väzbou. Sú to Lewisove kyseliny, čo sa využíva v organickej syntéze. Pripravujú sa reakciou oxidu boritého s kyselinou fluorovodíkovou, redukciou oxidu boritého uhlíkom v prúde chlóru atď.
- B2O3 + 6 HF → 2 BF3 + 3 H2O
- B2O3 + 3 C + 3 Cl2 → 2 BCl3 + 3 CO
Fluorid boritý je bezfarebný plyn, chlorid boritý a bromid boritý sú kvapalné, jodid boritý je tuhá látka.
Známe sú aj tetrafluoroboritany, keď dochádza k zmene hybridizácie atómu bóru z SP2 na SP3 Takto vzniknutý anión má tetraedrickú štruktúru a je pomerne stabilný. Samotná kyselina tetrafluoroboritá je silná kyselina, ktorá existuje len v roztoku. Pripravuje sa reakciou kyseliny boritej s fuorovodíkom:
- H3BO3 + 4 HF → H3O+ + BF4- + 2 H2O
Vzniká aj pri rozpúšťaní fluoridu boritého vo vode. Ostatné halogenidy borité sa vodou rozkladajú za vzniku oxidu boritého a príslušného halogénvodíka (v prípade jodidu boritého dokonca za výbuchu).
Halogenidy bórnaté majú planárnu štruktúru BX2-BX2. Chlorid bórnatý sa pripravuje účinkom elektrického výboja na pary chloridu boritého. Je to bezfarebná kvapalina, ktorá sa rozkladá na chloridy so vzorcom B4Cl4 a B8Cl8 (chloridy bórne). S vodou reaguje za vzniku kyseliny bórnatej H4B2O4.
Oxidy
[upraviť | upraviť zdroj]Oxid boritý (B2O3) je bezfarebná sklovitá látka, ktorá sa pripravuje priamou syntézou (spaľovaním bóru v kyslíkatom prostredí), alebo žíhaním kyseliny boritej. Veľmi ťažko kryštalizuje a jeho štruktúra je tvorená nepravidelne usporiadanými skupinami BO3 trojuholníkového tvaru, ktoré sú pospájané tak, že každý atóm kyslíka sa viaže s dvoma atómami bóru. V kryštalickom tvare je tvorený špirálovitými reťazcami BO4. Je to kyselilnotvorný oxid, s vodou reaguje za vzniku kyseliny boritej.
- B2O3 + 3 H2O → 2 H3BO3
Oxid bórnatý (B2O2) je plynná látka s redukčnými vlastnosťami. Známy je aj v tuhom stave ako (BO)x.
Ostatné binárne zlúčeniny
[upraviť | upraviť zdroj]
Nitrid bóru BN sa pripravuje reakciou bóru s dusíkom, prípadne s amoniakom v žiari. Je to chemicky veľmi stály biely prášok, ktorého štruktúra sa podobá štruktúre grafitu. Analogicky ako grafit, aj nitrid bóru pri vysokých teplotách a tlakoch prechádza na kubickú štruktúru diamantu, čím sa stáva veľmi tvrdým.
Veľmi tvrdý materiál je tiež karbid tetrabóru bóru B4C, používaný na výrobu brúsnych materiálov. Je to čierna, tažko taviteľná látka, ktorá sa pripravuje žíhaním bóru s uhlím v elektrickej peci.
Sulfid boritý je bezfarebná kryštalická látka, ktorá vzniká priamou reakciou oboch prvkov za zvýšenej teploty. Vodou sa rozkladá na kyselinu boritú a sírovodík.
Kyseliny bóru
[upraviť | upraviť zdroj]
Kyselina trihydrogenboritá H3BO3 je pomerne slabá jednosýtna kyselina. Je to perleťovo biela kryštalická látka, vo vode dobre rozpustná, pričom so zvyšovaním teploty rozpustnosť prudko vzrastá. Pripravuje sa pôsobením kyseliny chlorovodíkovej alebo sírovej na roztok tetraboritanu disodného (bóraxu).
- 2 HCl + Na2[B4O5(OH)4] + 3 H2O → 2 NaCl + 4 H3BO3
Kyselina boritá vo vode ionizuje viacerými spôsobmi
- H3BO3 + H2O → H3O+ + BO(OH)2−
- H3BO3 + 2 H2O → H3O+ + B(OH)4−
V koncentrovanejších roztokoch dochádza k tvorbe polymérnych iónov
- 3 H3BO3 → H3O+ + B3O3(OH)4− + H2O
Kyslosť roztoku kyseliny trihydrogenboritej sa môže zvýšiť pridaním glycerolu, alebo iných organických zlúčenín s viacerými hydroxylovými skupinami (cukrov), ktoré vytvárajú k kyselinou trihydrogenboritou cheláty, správajúce sa ako silné kyseliny. Táto vlastnosť sa využíva pri jej titračnom stanovení. Zahrievaním na teplotu 175 °C prechádza na kyselinu hydrogenboritú (HBO2)x, ďalším žíhaním dehydratuje až na oxid boritý.
Kyselina trihydrogenboritá je vo veľkom množstve jedovatá, v malých dávkach sa používa ako dezinfekčné činidlo, prípadne v oftalmológii na ošetrovanie očí. V prírode sa vyskytuje ako minerál sassolit.
Kyselina bórnatá (H4B2O4) vzniká reakciou chloridu bórnatého s vodou
- B2Cl4 + 4 H2O → H4B2O4 + 4 HCl
Je to tuhá látka s redukčnými vlastnosťami.
Boritany
[upraviť | upraviť zdroj]
Boritany je všeobecný názov zlúčenín, ktoré obsahujú anióny s väzbami B-O-B. Základnými jednotkami sú zoskupenia BO3, alebo BO4, ktoré sa cez atómy kyslíka spájajú a vytvárajú polymérne reťazcové, alebo kruhové útvary. Zriedkavo sa vyskytujú ortoboritany (napr. LaBO3, ScBO3), tvorené izolovanými aniónmi BO33−. Diboritanové anióny (B2O54−) tvoria dve skupiny BO3, ktoré zdieľajú jeden atóm kyslíka. Triboritany (B3O63−) majú cyklickú štruktúru, tvorenú hexagonálnymi útvarmi s delokalizovanými π-väzbami. Metaboritany sa skladajú z nekonečných reťazcov (BO2)22−.
Najznámejšie s celej skupiny sú rozličné hydratované polyboritany, v molekule ktorých sa vyskytujú spoločne skupiny BO3 aj BO4. Známy je tetraboritan disodný (bórax) (Na2[B4O5(OH)4]•8H2O), alebo pentaboritan draselný (K[B5O6(OH)4]•2H2O.
Boritany sa často vyskytujú v prírode, v laboratóriu sa pripravujú reakciami kyseliny boritej s hydroxidmi alkalických kovov, prípadne tavením kyseliny boritej s oxidmi, resp. hydroxidmi kovov. Vo vode sú rozpustné iba boritany alkalických kovov a ich vodné roztoky reagujú zásadito.
Ostatné zlúčeniny
[upraviť | upraviť zdroj]Borazol B3N3H6 je bezfarebná kvapalina aromatického zápachu, ktorá je štruktúrne podobná benzénu. No rozdelenie elektrónovej hustoty nie je rovnomerné, preto borazol ochotnejšie poskytuje adičné reakcie.
Výskyt v prírode
[upraviť | upraviť zdroj]Bór sa v prírode vyskytuje len v podobe zlúčenín ako kyselina boritá (sassolit), rozličné boritany (bórax). Celkový obsah bóru v zemskej kôre je 6×10−4. Celkový počet minerálov bóru je približne 80 a najdôležitejším z nich je kernit – Na2B4O6(OH)2·3H2O.
Výroba
[upraviť | upraviť zdroj]Výroba čistého bóru nie je jednoduchá záležitosť. Aj keď redukcia oxidu boritého horčíkom, alebo hliníkom je pomerne jednoduchá, vyredukovaný bór je znečistený príslušnými boridmi. Čistý bór sa pripravuje redukciou prchavých halogenidov vodíkom pri vysokých teplotách a vysoko čistý bór, používaný v polovodičovej technike, sa pripravuje termickým rozkladom diboránu a následnou rekryštalizáciou.
Využitie
[upraviť | upraviť zdroj]
Elementárny bór sa používa pri konštrukcii jadrových reaktorov a moderátorových tyčí ako absorbátor neutrónov. Významné miesto patrí zlúčeninám bóru aj v sklárskom a keramickom priemysle. Tzv. borosilikátové sklá sa vyznačujú vysokou tepelnou odolnosťou a pod označením Pyrex sa používajú na výrobu chemického a kuchynského riadu. V keramike sa bór používa predovšetkým ako zložka glazúr. Taktiež sa používa ako dopujúci prvok v polovodičoch.
Borid rénia, rovnako ako nitrid bóru a karbid bóru sa používajú vďaka ich vysokej tvrdosti ako brúsne látky (karbid bóru aj ako zložka nepriestrelných viest). Bórax býva zložkou pracích prostriedkov. Kyselina boritá má využitie ako insekticíd na hubenie mravcov a švábov. Zlúčeniny bóru sa používajú aj v pyrotechnike vďaka svojmu zelenému sfarbeniu plameňa.
Bór v biológii
[upraviť | upraviť zdroj]Bór má dôležitú úlohu v stavbe bunkových stien rastlín. Na druhej strane je zaujímavé, že koncentrácia bóru vyššia ako 1,8 ppm je pre väčšinu rastlín toxická.
V stopových množstvách je bór dôležitý aj pre cicavce, hoci jeho úloha v metabolizme nie je dostatočne preskúmaná.
Bór je taktiež zložkou v boromicíne, prírodnom antibiotiku.
Zdroje
[upraviť | upraviť zdroj]- Tento článok je čiastočný alebo úplný preklad článku boron na anglickej Wikipédii.
- Gažo, J. a kol.: Všeobecná a anorganická chémia, 1981, Alfa, Bratislava
Iné projekty
[upraviť | upraviť zdroj]| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Alkalické kovy | Kovy alk. zemín | Lantanoidy | Aktinoidy | Prechodné prvky | Kovy | Polokovy | Nekovy | Halogény | Vzácne plyny |

