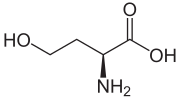
Homoserín
| Homoserín | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C4H9NO3 |
| Systematický názov | kyselina (S)-2-amino-4-hydroxybutánová |
| Synonymá | izotreonín |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 119,12 g/mol |
| Ďalšie informácie | |
| Číslo CAS | 211-590-6 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Homoserín alebo izotreonín je α-aminokyselina, ktorá sa podobá na serín. L-homoserín nie je aminokyselina kódovaná DNA, je to teda neproteínogénna aminokyselina. Od proteínogénneho serínu sa líši jednou metylénovou skupinou (–CH2–) naviac v bočnom reťazci. Homoserín (alebo jeho laktónová podoba) je produktom štiepenia peptidov obsahujúcich metionín pomocou brómkyánu.[1]
Obdobne ako ostatné biochemicky významné α-aminokyseliny, homoserín je chirálny a v živých systémoch sa vyskytuje jeho L- izomér.
Biosyntéza[upraviť | upraviť zdroj]
Homoserín je intermediátom v biosyntéze troch esenciálnych aminokyselín: metionínu, treonínu (ktorý je izomér homoserínu) a izoleucínu.[2][3] Celková biosyntetická dráha homoserínu zahŕňa glykolýzu, citrátový cyklus a metabolickú dráhu aspartátu cez aspartátsemialdehyd.[4] Aspartát sa premieňa na aspartyl-β-fosfát a potom na aspartátsemialdehyd.[5] Homoseríndehydrogenáza katalyzuje premenu aspartátsemialdehydu na homoserín pomocou NADPH.[6][5]

Ďalšie premeny[upraviť | upraviť zdroj]
Po syntéze homoserínu ho ďalšie dva enzýmy, homoserínkináza a homoserín O-sukcinyltransferáza, využívajú ako substrát na tvorbu fosfohomoserínu a O-sukcinylhomoserínu.[7] Fosfohomoserín sa premieňa pomocou treonínsyntázy na L-treonín.[5] Z O-sukcinylhomoserín je prekurzor L-metionínu.[8] Syntéza metionínu prebieha z cysteínu pomocou transsulfuračnej cesty.
Homoserín alostericky inhibuje aspartátkinázu a glutamátdehydrogenázu.[7] Glutamátdehydrogenáza reverzibilne premieňa glutamát na α-ketoglutarát, ktorý sa potom premieňa na oxalacetát pomocou citrátového cyklu. Treonín pôsobí ako ďalší alosterický inhibítor aspartátkinázy a homoseríndehydrogenázy, ale zároveň je i kompetitívnym inhibítorom homoserínkinázy.[8]
Použitie[upraviť | upraviť zdroj]
Komerčne sa homoserín používa ako prekurzor v syntéze izobutanolu a 1,4-butándiolu.[9] Purifikovaný homoserín sa používa pri štúdiách štruktúry enzýmov.[10] Homoserín takisto hrá dôležitú úlohu pri hodnotení syntézy peptidov a syntézy proteoglykánových glykopeptidov.[11] Kultúry bakteriálnych bunkových stien sú schopné vytvoriť veľké množstvo tejto aminokyseliny.[7][9]
Referencie[upraviť | upraviť zdroj]
- ↑ KAISER, Raymond; METZKA, Lorraine. Enhancement of Cyanogen Bromide Cleavage Yields for Methionyl-Serine and Methionyl-Threonine Peptide Bonds. Analytical Biochemistry, 1999-01-01, roč. 266, čís. 1, s. 1–8. Dostupné online [cit. 2022-12-07]. ISSN 0003-2697. DOI: 10.1006/abio.1998.2945. (po anglicky)
- ↑ Studies on the Synthesis of l -Amino Acids: Part III. A Synthesis of l -Homoserine from l -Aspartic Acid. Agricultural and Biological Chemistry, September 1961, s. 678–679. Dostupné online. ISSN 0002-1369. DOI: 10.1080/00021369.1961.10857862. (po anglicky)
- ↑ ŠKÁRKA, Bohumil; FERENČÍK, Miroslav. Biochémia. 3. vyd. [s.l.] : [s.n.], 1992. ISBN 80-05-01076-1. S. 285.
- ↑ Berg, J. M.; Stryer, L. et al. (2002), Biochemistry. W.H. Freeman. ISBN 0-7167-4684-0
- ↑ a b c VOET, Donald. Biochemistry. Hoboken, NJ : John Wiley & Sons, 2011. (4th edition.) Dostupné online. ISBN 978-0-470-57095-1. S. 1073.
- ↑ The Central Enzymes of the Aspartate Family of Amino Acid Biosynthesis. Accounts of Chemical Research, 2001, s. 339–349. DOI: 10.1021/ar000057q. PMID 11352712.
- ↑ a b c Multiplex Design of the Metabolic Network for Production of l-Homoserine in Escherichia coli. Applied and Environmental Microbiology, October 2020. DOI: 10.1128/AEM.01477-20. PMID 32801175.
- ↑ a b Reduction of Feedback Inhibition in Homoserine Kinase (ThrB) of Corynebacterium glutamicum Enhances l-Threonine Biosynthesis. ACS Omega, January 2018, s. 1178–1186. DOI: 10.1021/acsomega.7b01597. PMID 30023797.
- ↑ a b Metabolic engineering of E. coli for the production of O-succinyl-l-homoserine with high yield. 3 Biotech, July 2018, s. 310. DOI: 10.1007/s13205-018-1332-x. PMID 30002999.
- ↑ The crystal structure of homoserine dehydrogenase complexed with l-homoserine and NADPH in a closed form. Journal of Biochemistry, February 2019, s. 185–195. DOI: 10.1093/jb/mvy094. PMID 30423116.
- ↑ Homoserine as an Aspartic Acid Precursor for Synthesis of Proteoglycan Glycopeptide Containing Aspartic Acid and a Sulfated Glycan Chain. The Journal of Organic Chemistry, December 2016, s. 12052–12059. DOI: 10.1021/acs.joc.6b02441. PMID 27809505.
Zdroj[upraviť | upraviť zdroj]
Tento článok je čiastočný alebo úplný preklad článku Homoserine na anglickej Wikipédii.
