Izoleucín
| Izoleucín | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C6H13NO2 |
| Systematický názov | Kyselina (2S,3S)-2-amino-3-metylpentánová |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 131,175 g/mol |
| Ďalšie informácie | |
| Číslo CAS | L: 73-32-5 |
| SMILES | CC[C@H](C)[C@@H](C(=O)O)N |
| 3D model (JSmol) | Interaktívny 3D model |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Izoleucín (skratka Ile alebo I[1]) je α-aminokyselina, ktorá sa objavuje pri biosyntéze bielkovín. Obsahuje α-aminoskupinu (ktorá je za fyziologických podmienok v protónovanom stave −NH3+), α-karboxylovú skupinu (ktorá je za fyziologických podmienok v deprotónovanej forme −COO-) a uhľovodíkový bočný reťazec (s centrálnym atómom uhlíka viazanom na tri ďalšie atómy uhlíka). Je klasifikovaný ako nepolárna, nenabitá (pri fyziologickom pH), alifatická aminokyselina s rozvetveným reťazcom. Pre ľudí je nevyhnutný, čo znamená, že telo si ho nedokáže syntetizovať a musí byť prijímané v strave. Izoleucín sa syntetizuje z pyruvátu pomocou enzýmov biosyntézy leucínu v iných organizmoch, ako sú baktérie.[2] Je kódovaný kodónmi AUU, AUC a AUA.
Izoleucín je konštitučný izomér leucínu. Sú to jediné dve proteinogénne aminokyseliny s rovnakým sumárnym vzorcom, čo komplikuje ich rozlíšenie pri stanovení hmotnostnou spektrometriou peptidov. V takých prípadoch je možné ich súhrnne označiť skratkami Xle[3] alebo J.[3][4]
Chemická syntéza
[upraviť | upraviť zdroj]Izoleucín je možné syntetizovať viacstupňovým postupom z 2-brómbutánu a dietylmalonátu.[5] Syntetický izoleucín bol pôvodne opísaný v roku 1905 francúzskym chemikom Louisom Bouveaultom.[6]
Nemecký chemik Felix Ehrlich objavil izoleucín v roku 1903 v hemoglobíne.[chýba zdroj]
Metabolizmus
[upraviť | upraviť zdroj]
Biosyntéza
[upraviť | upraviť zdroj]Izoleucín je esenciálna aminokyselina, takže sa v tele nesyntetizuje, preto sa musí prijímať v strave, zvyčajne ako súčasť bielkovín. V rastlinách a mikroorganizmoch sa syntetizuje v niekoľkých krokoch, počínajúc pyruvátom a alfa-ketobutyrátom. Enzýmy zapojené do tejto biosyntézy sú:[7]
- Acetolaktátsyntáza
- Izomeroreduktáza acetohydroxykyselín
- Dehydratáza dihydroxykyselín
- Valínaminotransferáza
Katabolizmus
[upraviť | upraviť zdroj]Izoleucín je glukogénna aj ketogénna aminokyselina. Po transaminácii s alfa-ketoglutarátom sa uhlíkový skelet oxiduje a štiepi na propionyl-CoA a acetyl-CoA. Propionyl-CoA sa premieňa na sukcinyl-CoA, jeden z medziproduktov citrátového cyklu, ktorý sa môže premeniť na oxaloacetát a vstúpiť do glukoneogenézy (preto je izoleucín glukogénny). U cicavcov sa acetyl-CoA nemôže premeniť na uhľohydráty, ale môže vstúpiť do citrátového kondenzáciou s oxaloacetátom za vzniku citrátu, takisto sa môže použiť pri syntéze ketolátok (preto je izoleucín aj ketogénny) alebo mastných kyselín.[8]
Rezistencia na inzulín
[upraviť | upraviť zdroj]Izoleucín, podobne ako iné aminokyseliny s rozvetveným reťazcom, je spojený s inzulínovou rezistenciou: v krvi diabetických myší, potkanov a ľudí sú pozorované vyššie hladiny izoleucínu.[9] Myši kŕmené jeden deň izoleucínovou deprivačnou diétou mali zlepšenú citlivosť na inzulín a kŕmenie izoleucínovou deprivačnou diétou počas jedného týždňa výrazne znížilo hladinu glukózy v krvi.[10] U obéznych myší (ktorých obezita bola dosiahnutá pomocou stravy) a myší rezistentných na inzulín mala diéta so zníženými hladinami izoleucínu (s alebo bez iných aminokyselín s rozvetveným reťazcom) za následok zníženie adipozity a zlepšenie citlivosti na inzulín.[11][12] Pre priaznivé metabolické účinky nízkobielkovinovej diéty sú potrebné nižšie hladiny izoleucínu v strave.[12] U ľudí diéta s obmedzeným množstvom bielkovín znižuje hladinu izoleucínu v krvi a znižuje hladinu glukózy v krvi nalačno.[13] Vyššia hladina izoleucínu v strave je u ľudí spojená s vyšším indexom telesnej hmotnosti.[12]
Zdroje v potrave a význam
[upraviť | upraviť zdroj]Aj keď sa táto aminokyselina u zvierat nevytvára, uchováva sa vo veľkých množstvách. Potraviny s vysokým obsahom izoleucínu zahŕňajú vajcia, sójový proteín, morské riasy, morčacie mäso, kuracie mäso, jahňacie mäso, syry a ryby.[14]
Výbor pre potravu a výživu (FNB) amerického Inštitútu medicíny stanovil odporúčané denné dávky pre esenciálne aminokyseliny v roku 2002. V prípade izoleucínu je to pre dospelých vo veku 19 rokov a starších 19 mg/kg telesnej hmotnosti/deň.[15]
Okrem svojej biologickej úlohy ako živiny sa ukázalo, že izoleucín sa podieľa aj na regulácii metabolizmu glukózy.[16]
Niektoré zdroje uvádzajú, že izoleucín znižuje únavu,[17] avšak podľa review z roku 2019 nemajú BCAA výrazný efekt na zníženie únavy.[18] Pomáhajú však so znížením hladiny laktátu (ktorý vzniká počas cvičenia a jeho hromadenie v svaloch sa prejavuje ako svalovica) a okrem toho pomáhajú regulovať hladiny amoniaku (ktorý spolu s laktátom spôsobuje únavu), glukózy, voľných mastných kyselín a kreatínkinázy.[18]
Izoméry
[upraviť | upraviť zdroj]Izoleucín je jednou z dvoch proteinogénnych aminokyselín, ktoré majú dve chirálne centrá. Druhou je treonín. Prítomnosť dvoch chirálnych centier v tomto prípade vedie k celkom štyrom rôznym izomérom podľa Le Belovho-van ’t Hoffov vzťahu. V živých systémoch je prítomný len L-izoleucín.
Izoleucín je konštitučný izomér leucínu.
Z izoméru L-aloizoleucínu sa syntetizuje kyselina koronamová, ktorá je súčasťou fytotoxínu koronatínu, ktorý produkuje baktéria Pseudomonas syringae.[19] Ako aloizoleucín vzniká nie je známe.
| Izoméry izoleucínu | |||||||
|---|---|---|---|---|---|---|---|
| Triviálny názov | izoleucín | d-izoleucín | l-izoleucín | dl-izoleucín | d-aloizoleucín | l-aloizoleucín | dl-aloizoleucín |
| Synonymum | (R)-izoleucín | L-(+)-izoleucín | (R*,R*)-izoleucín | aloizoleucín | |||
| CAS číslo | 443-79-8 | 319-78-8 | 73-32-5 | 1509-35-9 | 1509-34-8 | 3107-04-8 | |
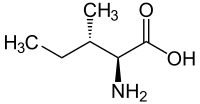 
|
| L-izoleucín (2S,3S) a D-izoleucín (2R,3R) |
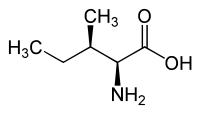 
|
| L-aloizoleucín (2S,3R) a D-aloizoleucín (2R,3S) |
Referencie
[upraviť | upraviť zdroj]- ↑ Nomenclature and Symbolism for Amino Acids and Peptides [online]. IUPAC-IUB Joint Commission on Biochemical Nomenclature, 1983. Dostupné online. Archivované 2008-10-09 z originálu.
- ↑ Pathway for isoleucine formation form pyruvate by leucine biosynthetic enzymes in leucine-accumulating isoleucine revertants of Serratia marcescens. Journal of Biochemistry, July 1977, s. 95–103. DOI: 10.1093/oxfordjournals.jbchem.a131698. PMID 142769.
- ↑ a b Codes Used in Sequence Description [online]. www.ddbj.nig.ac.jp, [cit. 2023-06-30]. Dostupné online. (po anglicky)
- ↑ Selenocysteine [online]. iubmb.qmul.ac.uk, [cit. 2023-06-30]. Dostupné online.
- ↑ dl-ISOLEUCINE. Organic Syntheses, 1941, roč. 21, s. 60. Dostupné online [cit. 2022-10-12]. ISSN 0078-6209. DOI: 10.15227/orgsyn.021.0060. (po anglicky)
- ↑ Action du sodium sur les éthers des acides monobasiques à fonction simple de la série grasse. Compt. Rend., 1905, s. 1593–1595. Dostupné online. (po francúzsky)
- ↑ LEHNINGER, Albert L.. Lehninger principles of biochemistry.. New York : Worth Publishers, 2000. (3rd ed..) Dostupné online. ISBN 1-57259-153-6.
- ↑ COLE, Jeffrey T.. Branched Chain Amino Acids in Clinical Nutrition. [s.l.] : [s.n.], 14 November 2014. ISBN 978-1-4939-1923-9. Chapter 2: Metabolism of BCAAs.
- ↑ Branched-chain amino acids in metabolic signalling and insulin resistance. Nature Reviews. Endocrinology, December 2014, s. 723–36. DOI: 10.1038/nrendo.2014.171. PMID 25287287.
- ↑ Effects of individual branched-chain amino acids deprivation on insulin sensitivity and glucose metabolism in mice. Metabolism, June 2014, s. 841–50. DOI: 10.1016/j.metabol.2014.03.006. PMID 24684822.
- ↑ Restoration of metabolic health by decreased consumption of branched-chain amino acids. The Journal of Physiology, February 2018, s. 623–645. DOI: 10.1113/JP275075. PMID 29266268.
- ↑ a b c The adverse metabolic effects of branched-chain amino acids are mediated by isoleucine and valine. Cell Metabolism, May 2021, s. 905–922.e6. DOI: 10.1016/j.cmet.2021.03.025. PMID 33887198.
- ↑ Decreased Consumption of Branched-Chain Amino Acids Improves Metabolic Health. Cell Reports, July 2016, s. 520–530. DOI: 10.1016/j.celrep.2016.05.092. PMID 27346343.
- ↑ Foods highest in Isoleucine [online]. Condé Nast. Dostupné online.
- ↑ INSTITUTE OF MEDICINE. Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Washington, DC : The National Academies Press, 2002. Dostupné online. ISBN 978-0-309-08525-0. DOI:10.17226/10490 Protein and Amino Acids, s. 589–768.
- ↑ YOSHIZAWA, Fumiaki. Effects of Leucine and Isoleucine on Glucose Metabolism. [s.l.] : [s.n.], October 2015. Dostupné online. ISBN 978-1-4939-1922-2. DOI:10.1007/978-1-4939-1923-9_6 S. 63–73.
- ↑ BCAA - Ako vybrať najlepšie aminokyseliny ? Dávkovanie a Ceny [online]. Fitgo, [cit. 2017-12-04]. Dostupné online.
- ↑ a b HORMOZNEJAD, Razie; ZARE JAVID, Ahmad; MANSOORI, Anahita. Effect of BCAA supplementation on central fatigue, energy metabolism substrate and muscle damage to the exercise: a systematic review with meta-analysis. Sport Sciences for Health, 2019-08-01, roč. 15, čís. 2, s. 265–279. Dostupné online [cit. 2022-10-12]. ISSN 1825-1234. DOI: 10.1007/s11332-019-00542-4. (po anglicky)
- ↑ VAILLANCOURT, Frédéric H.; YEH, Ellen; VOSBURG, David A.. Cryptic chlorination by a non-haem iron enzyme during cyclopropyl amino acid biosynthesis. Nature, 2005-08, s. 1191–1194. Dostupné online. ISSN 1476-4687. DOI: 10.1038/nature03797. (po anglicky)
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Isoleucine na anglickej Wikipédii.
