Glycín
| Glycín | ||||||||||||||||||||
 | ||||||||||||||||||||
 | ||||||||||||||||||||
| Všeobecné vlastnosti | ||||||||||||||||||||
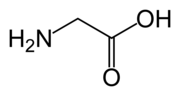
| Sumárny vzorec | C2H5NO2 | |||||||||||||||||||
| Systematický názov | Kyselina 2-aminoetánová | |||||||||||||||||||
| Synonymá | Glykokol | |||||||||||||||||||
| Vzhľad | biela pevná látka | |||||||||||||||||||
| Fyzikálne vlastnosti | ||||||||||||||||||||
| Molekulová hmotnosť | 75,1 u | |||||||||||||||||||
| Molárna hmotnosť | 75,07 g/mol | |||||||||||||||||||
| Teplota rozkladu | 232 – 236 °C | |||||||||||||||||||
| Hustota | 1,607 g/cm³ | |||||||||||||||||||
| pKA | 2,34 (karboxyl), 9,6 (amino) | |||||||||||||||||||
| ||||||||||||||||||||
| Ďalšie informácie | ||||||||||||||||||||
| Číslo CAS | 56-40-6 | |||||||||||||||||||
| EINECS číslo | 200-272-2 | |||||||||||||||||||
| Číslo RTECS | MB7600000 | |||||||||||||||||||
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | ||||||||||||||||||||
Glycín (skratka Gly alebo G[1]) je aminokyselina s nepolárnym postranným reťazcom. Na rozdiel od ostatných nepolárnych aminokyselín (Ala, Val, Leu, Ile, Pro, Met, Phe, Trp) jej celkový charakter však nie je príliš nepolárny. Ide o najjednoduchšiu z 22 proteínogénnych (kódovaných) aminokyselín.
Glycín má rovnaký sumárny vzorec ako nitroetán. Väčšina proteínov obsahuje iba malé množstvo glycínu. Dôležitou výnimkou je kolagén, ktorý sa z jednej tretiny skladá z glycínu. Dôvod spočíva v tom, že ďalšiu približne tretinu kolagénneho vlákna zaujímajú prolín a hydroxyprolín. Obe tieto aminokyseliny majú obmedzené možnosti rotácie a glycín tak vyrovnáva deformačné vplyvy týchto aminokyselín na štruktúru kolagénového vlákna. Vo veľkom množstve sa glycín nachádza aj v elastíne.
Kódujú ho kodóny GGU, GGC, GGA a GGG (súhrnne GGN).
Chemické vlastnosti
[upraviť | upraviť zdroj]Glycín ako jediná biogénna aminokyselina nie je opticky aktívny: kvôli prítomnosti dvoch vodíkov na α-uhlíku má rovinu symetrie (nemôže sa teda rozlíšiť D- a L-glycín). Z dôvodu krátkeho bočného reťazca sa môže glycín viazať na miesta, na ktoré sa iné aminokyseliny zo sterických dôvodov viazať nemôžu. Z tohto dôvodu je Ramachandranov diagram glycínu odlišný od väčšiny aminokyselín. Napríklad iba glycín môže byť vnútornou aminokyselinou kolagénnej závitnice.
Glycín je evolučne veľmi stabilný na dôležitých miestach niektorých proteínov (napríklad v cytochróme c, myoglobíne a hemoglobíne), pretože mutácie meniace túto aminokyselinu za inú s väčším bočným reťazcom výrazne menia štruktúru proteínu. Ďalším príkladom je aktívne centrum proteázy chymotrypsínu, ktorá štiepi enzýmy za objemnejšími aminokyselinami typu fenylalanín, tryptofán, tyrozín, a preto aj tu má zámena glycínu vážne dôsledky. Enzým neschopný katalýzy je vyradený z činnosti v proteazóme.[chýba zdroj] Takisto je známe, že glycín narúša sekundárne štruktúry bielkovín kvôli svojej flexibilite.[2]
Fyziologické účinky
[upraviť | upraviť zdroj]Glycín je inhibičný neuroprenášač v CNS, obzvlášť v mieche, mozgovom kmeni a v sietnici. Aktiváciou glycínových iónotropných receptorov na postsynaptickej membráne sa otvárajú iónové kanály a chloridové ióny vstupujú do neurónu, čo pôsobí hyperpolarizáciu a tzv. inhibičný postsynaptický potenciál (IPSP). Strychnín je antagonista inotropných glycínových receptorov. Glycín je spoločne s glutamátom ligandom NMDA receptorov. Na rozdiel od inhibičných účinkov v mieche, na NMDA glutamínergných receptoroch má glycín účinky excitačné. LD50 glycínu je 7930 mg/kg pre potkana (orálne) a smrť je spôsobená hyperexcitabilitou nervovej sústavy.
Metabolizmus
[upraviť | upraviť zdroj]Biosyntéza
[upraviť | upraviť zdroj]Glycín nie je esenciálna aminokyselina, čo znamená, že telo je schopné syntetizovať jej potrebné množstvo samo bez nutnosti jej prísunu v potrave. Biosyntéza prebieha z aminokyseliny serín, ktorá je vyrábaná z 3-fosfoglycerátu. U väčšiny organizmov túto reakciu katalyzuje enzým serínhydroxymetyltransferáza s pomocou kofaktoru pyridoxalfosfátu (pyridoxal je druh vitamínu B6):[3]
- serín + tetrahydrofolát → glycín + 5,10-metyléntetrahydrofolát + H2O
Tento enzým prenáša metylénovú skupinu zo serínu na tetrahydrofolát, v procese vzniká 5,10-metyléntetrahydrofolát a štiepi sa voda.
V pečeni stavovcov je syntéza glycínu katalyzovaná enzýmom glycínsyntázou (alebo GDC – komplex glycíndekarboxylázy). Táto reakcia je reverzibilná:[3]
- CO2 + NH4+ + 5,10-metyléntetrahydrofolát + NADH + H+ → glycín + tetrahydrofolát + NAD+
Degradácia
[upraviť | upraviť zdroj]Glycín je degradovaný tromi rôznymi cestami. V živočíchoch prevažuje cesta cez enzým glycíndekarboxylázu (rovnaký enzým ako ten, ktorý sa zúčastňuje biosyntézy). Táto cesta je spätná reakcia biosyntézy:[3]
- glycín + tetrahydrofolát + NAD+ → CO2 + NH4+ + 5,10-metyléntetrahydrofolát + NADH + H+
Druhá cesta je dvojkroková. Prvý krok je spätná reakcia biosyntézy zo serínu enzýmom serínhydroxymetyltransferáza. Serín je potom premenený na pyruvát enzýmom seríndehydratázou.[3]
V tretej ceste je glycín premenený na glyoxylát pomocou oxidázy D-aminokyselín. Glyoxylát je potom oxidovaný pečeňovou laktátdehydrogenázou na oxalát v reakcii, ktorá využíva NAD+.[3]
Prítomnosť v medzihviezdnom priestore
[upraviť | upraviť zdroj]V roku 1994 skupina astronómov z Illinoiskej univerzity v Urbana-Champaign, vedenej Lewisom Snyderom, ohlásila objav molekúl glycínu vo vesmírnom priestore.[4] Nasledujúcimi analýzami sa ukázalo, že tento objav nemôže byť potvrdený. O deväť rokov neskôr, v 2003, Yi-Jehng Kuan z National Taiwan Normal University a Steve Charnley detegovali medzihviezdny glycín v troch zdrojoch medzihviezdnej hmoty.[5] Ohlásili identifikáciu 27 spektrálnych čiar glycínu pomocou rádioteleskopu. Podľa počítačových simulácií a laboratórnych experimentov vznikol glycín pravdepodobne tak, že ľadové častice obsahujúce jednoduché organické molekuly boli vystavené ultrafialovému žiareniu. V októbri 2004 Snyder a spolupracovníci znovu preskúmali Kuanov objav glycínu. Snyder dokázal, že glycín nebol ani v jednom z troch zdrojov správne detegovaný.[6]
Referencie
[upraviť | upraviť zdroj]- ↑ Nomenclature and Symbolism for Amino Acids and Peptides [online]. iupac.qmul.ac.uk, [cit. 2023-04-07]. Dostupné online.
- ↑ IMAI, Kenichiro; MITAKU, Shigeki. Mechanisms of secondary structure breakers in soluble proteins. BIOPHYSICS, 2005, roč. 1, s. 55–65. Dostupné online [cit. 2022-10-25]. ISSN 1349-2942. DOI: 10.2142/biophysics.1.55. (po anglicky)
- ↑ a b c d e NELSON, David L; COX, Michael M.. Principles of Biochemistry. Zväzok 4. New York : W. H. Freeman, 2005. ISBN 0-7167-4339-6. S. 127, 675–77, 844, 854.
- ↑ TRAVIS, John. Hints of First Amino Acid Outside Solar System. Science, 1994-06-17, roč. 264, čís. 5166, s. 1668–1668. Dostupné online [cit. 2022-10-25]. ISSN 0036-8075. DOI: 10.1126/science.264.5166.1668.a. (po anglicky)
- ↑ KUAN, YJ; CHARNLEY, SB; HUANG, HC. Interstellar Glycine. The Astrophysical Journal, 2003. Dostupné online [cit. 2022-10-25]. (po anglicky)
- ↑ SNYDER, L. E.; LOVAS, F. J.; HOLLIS, J. M.. A Rigorous Attempt to Verify Interstellar Glycine. The Astrophysical Journal, 2005-02-01, roč. 619, čís. 2. Dostupné online [cit. 2022-10-25]. ISSN 0004-637X. DOI: 10.1086/426677/meta. (po anglicky)
Literatúra
[upraviť | upraviť zdroj]- Safety (MSDS) data for glycine Archivované 2007-10-20 na Wayback Machine, 2005, The Physical and Theoretical Chemistry Laboratory Oxford University
- Dawson, RMC, Elliott, DC, Elliott, WH, and Jones, KM, Data for Biochemical Research (3rd edition), pp. 1 – 31 (1986)
Iné projekty
[upraviť | upraviť zdroj] Commons ponúka multimediálne súbory na tému Glycín
Commons ponúka multimediálne súbory na tému Glycín
Externé odkazy
[upraviť | upraviť zdroj]- PDRHealth - Glycine
- Computational Chemistry Wiki
- Glycine cleavage system
- Ageing cells offer new target for Alzheimer's therapy
Zdroj
[upraviť | upraviť zdroj]Tento článok je čiastočný alebo úplný preklad článku Glycin na českej Wikipédii.
