Metionín
| Metionín | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C5H11NO2S |
| Systematický názov | Kyselina 2-amino-4-(metyltio)butánová |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 149,21 g/mol |
| pKA | 2,28 (karboxyl) 9,21 (amino) |
| Ďalšie informácie | |
| Číslo CAS | L: 63-68-3 D/L: 59-51-8 |
| SMILES | CSCC[C@H](N)C(=O)O |
| 3D model (JSmol) | Interaktívny 3D model |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
Metionín (skratka Met alebo M[1]) je aminokyselina, ktorá je nevyhnutnou súčasťou bielkovín v živých organizmoch. Organizmus človeka ju ale nevie syntetizovať, preto je odkázaný na jej prísun potravou. Je to jedna z dvoch proteinogénnych aminokyselín, ktoré obsahujú síru, pričom druhou je cysteín.
Metabolizmus
[upraviť | upraviť zdroj]Metionín sa u baktérií syntetizuje z aspartátu. Najprv dochádza postupne k redukcii aspartátu na homoserín, ktorý sa aktivuje a kondenzuje s cysteínom za vzniku cystatiónu. Ten sa následne štiepi za vzniku metionínu.[2] Cystationín sa alternatívne môže štiepiť na homocysteín, ktorý potom metionínsyntáza premieňa na metionín.[2]
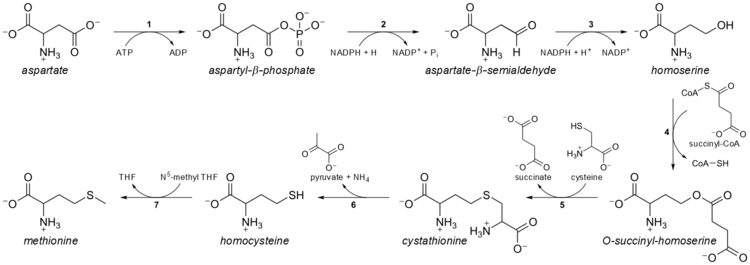
Rozkladovými produktmi metionínu sú koenzým SAM a cysteín, ktoré vznikajú v transsulfuračnej ceste.[2] Cysteín sa následne rozkladá na pyruvát.[2]
Biologický význam
[upraviť | upraviť zdroj]Metionín e zdrojom síry, preto zabraňuje problémom s pokožkou a jej derivátmi. Podporuje rast vlasov. Tým, že zvyšuje produkciu lecitínu v pečeni, pomáha znižovať hladinu cholesterolu. Zároveň znižuje obsah tuku v obličkách a pečeni. Reguluje tvorbu amoniaku, zabraňuje dráždeniu močového mechúra tým, že znižuje množstvo amoniaku v moči. Je prirodzená chelatačná látka pre ťažké kovy.[chýba zdroj]
Metionín má dôležitú úlohu i v proteín-proteínových interakciách. Rotácia dihedrálneho uhla okolo S–C väzby nemá prakticky žiadnu bariéru, takže sa koncová metylová skupina môže voľne otáčať, čo umožňuje lepšie priestorové prispôsobenie počas interakcií dvoch proteínov.[3]
Translácia
[upraviť | upraviť zdroj]V mediátorovej ribonukleovej kyseline kóduje metiónín sekvencia AUG, ktorá je zároveň iniciačným kodónom translácie. To znamená, že syntéza nového peptidového reťazca vždy začína metionínom. Nie každá funkčná bielkovina má však na začiatku metionín, pretože počas posttranslačných úprav býva niekedy odštiepený. Metionín môže byť pri translácii zaradený aj dovnútra peptidového reťazca, pokiaľ sa sekvencia AUG nachádza medzi inými kodónmi. U prokaryotov sa začína translácia formylovaným metionínom – N-formylmetionín.[2]
Úloha v oxidatívnom strese
[upraviť | upraviť zdroj]Metionínové reziduá na porvrchu proteínov môžu zároveň fungovať ako antioxidanty a vychytávať reaktívne formy kyslíka (ROS), čím môžu pomáhať predísť oxidatívnemu stresu.[3] Oxidácia niektorých takýchto metionínových reziduí má malý alebo nemá prakticky žiadny vplyv na stabilitu a štruktúru proteínu.[3] To zároveň potvrdzuje štúdia, počas ktorej bol v bakteriálnej proteosyntéze metionín nahradený norleucínom (podobná aminokyselina, ktorá namiesto síry obsahuje –CH2– skupinu), avšak tieto baktérie boli počas oxidačného stresu menej životaschopné oproti neupraveným baktériám.[3] V procese sa môže reverzibilne oxidovať na metionínsulfoxid. Túto úlohu takisto potvrdzuje fakt, že nebol objavený enzým, v ktorom by sa metionín účastnil katalytického cyklu alebo by metionín plnil štruktúrnu úlohu, v ktorej by bol nenahraditeľný.[4] Jeho doplnenie do genetického kódu teda prebehlo pravdepodobne až po vývoji kyslíka v atmosfére a bola to jedna z posledných aminokyselín pridaná do genetického kódu.[4]
Oxidácia metionínových reziduí môže prebiehať i cielene (a to stereošpecificky) pomocou rôznych enzýmov. Táto zmena môže v niektorých prípadoch ovplyvniť stabilitu proteínu, jeho lokalizáciu alebo aktivitu, podobne ako v prípade fosforylácie.[3] Táto oxidácia môže potenciálne pôsobiť i v rámci signalizácie a ovplyvniť aktivitu kináz či fosfatáz.[3]
Prírodné zdroje
[upraviť | upraviť zdroj]Nedostatok metionínu je najmä v strukovinách vrátane sóje, naopak bohato sa nachádza v slnečnicových jadrách.[chýba zdroj]
Niektoré prírodné zdroje sú bohaté na selenometionín, selénový analóg metionínu.[5]
Referencie
[upraviť | upraviť zdroj]- ↑ Nomenclature and Symbolism for Amino Acids and Peptides [online]. iupac.qmul.ac.uk, [cit. 2023-04-07]. Dostupné online.
- ↑ a b c d e VOET, Donald. Biochemistry. Hoboken, NJ : John Wiley & Sons, 2011. (4th edition.) Dostupné online. ISBN 978-0-470-57095-1. S. 1030, 1036, 1072-1073, 1371-1379.
- ↑ a b c d e f ALEDO, Juan C.. Methionine in proteins: The Cinderella of the proteinogenic amino acids. Protein Science, 2019-10, roč. 28, čís. 10, s. 1785–1796. Dostupné online [cit. 2022-10-21]. ISSN 0961-8368. DOI: 10.1002/pro.3698. (po anglicky)
- ↑ a b GRANOLD, Matthias; HAJIEVA, Parvana; TOŞA, Monica Ioana. Modern diversification of the amino acid repertoire driven by oxygen. Proceedings of the National Academy of Sciences, 2018-01-02, roč. 115, čís. 1, s. 41–46. Dostupné online [cit. 2022-10-21]. ISSN 0027-8424. DOI: 10.1073/pnas.1717100115. (po anglicky)
- ↑ WHANGER, P. D.. Selenocompounds in plants and animals and their biological significance. Journal of the American College of Nutrition, 2002, s. 223–32. DOI: 10.1080/07315724.2002.10719214. PMID 12074249.
