Chlór
| Chlór (chlorum) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vzhľad | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| žltozelený plyn | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Emisné spektrum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atómové vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atómová hmotnosť | 35,453 g·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrónová konfigurácia | [Ne] 3s2 3p5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atómový polomer | 100 pm (vyp.: 79 pm) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentný polomer | 102 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsov pol. | 175 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iónový polomer pre: Cl- |
181 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chemické vlastnosti | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativita | 3,16 (podľa Paulinga) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ionizačná energia(e) | 1: 1 251,2 kJ.mol−1 2: 2 298 kJ.mol−1 3: 3 822 kJ.mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidačné číslo(a) | -I, I, III, V, VII | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Št. potenciál (Cl2/Cl-) |
1,3595 V | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fyzikálne vlastnosti (za norm. podmienok) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Skupenstvo | plynné | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hustota | 0,0032 kg·dm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hustota kvapaliny (pri 171,6 K) |
1,5625 kg·dm−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota topenia | 171,6 K (−101,55 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Teplota varu | 239,11 K (−34,04 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kritický bod | 416,9 K; 7,991 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sk. teplo topenia | 6,406 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sk. teplo varu | 20,41 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tepelná kapacita | 33,949 J·mol−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Iné | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kryštálová sústava | rombická | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizmus | diamagnetický | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrický odpor | 10x103 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tep. vodivosť | 8,9x10−3 W·m−1·K−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rýchl. zvuku | 206 m·s−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Reg. číslo CAS | 7782-50-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotop(y) (vybrané) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Chlór (lat. chlorum) je chemický prvok, ktorý má značku Cl a protónové číslo 17. V periodickej tabuľke sa zaraďuje medzi halogény.
Je toxický, za normálnych podmienok žltozelený plyn s charakteristickým zápachom[1], ktorý sa ochotne zlučuje s väčšinou prvkov periodickej tabuľky[2]. Elektrónová konfigurácia chlóru je [Ne] 3s2 3p5 a v zlúčeninách nadobúda oxidačné čísla od -I až po +VII[3]. Priemyselne sa využíva ako oxidačné činidlo, na dezinfekciu vody a ako bieliace činidlo. Taktiež zlúčeniny chlóru majú široké priemyselné využitie[4].
História[upraviť | upraviť zdroj]

Najbežnejšia zlúčenina chlóru – kamenná soľ je známa od staroveku a v starovekom Ríme bola dokonca občas aj súčasťou výplaty žoldu. Rovnako sú o soli zmienky v aj Biblii[5]. V stredoveku, približne od 13. storočia bola alchymistom známa aqua regia, zmes kyseliny chlorovodíkovej a dusičnej, ktorá sa používala na rozpúšťanie zlata[5]. Samotnú koncentrovanú kyselinu chlorovodíkovú pripravil v roku 1648 nemecký chemik Johann Rudolf Glauber zahrievaním hydratovaného chloridu zinočnatého a príprava elementárneho chlóru sa podarila v roku 1774 Carlovi Wilhelmovi Scheelemu oxidáciou chloridu sodného oxidom manganičitým v kyslom prostredí[5] podľa rovnice:
- 4 NaCl + 2 H2SO4 + MnO2 → 2 Na2SO4 + MnCl2 + 2 H2O + Cl2
Scheele však veril, že pripravil len ďalšiu zlúčeninu, za nový chemický prvok ho prehlásil až sir Humphry Davy v 1811 a súčasne ho aj pomenoval podľa charakteristickej farby – zo starogr. χλωρος – žltozelený[5].
Chlór mal využitie hlavne ako bieliace činidlo, už samotný Scheele objavil jeho bieliace účinky a prvý prípravok na bielenie pod názvom eau de Javel uviedol Berthollet v 1785. Bol to chlórnan draselný, pripravený zavádzaním plynného chlóru do roztoku hydroxidu draselného[5].
- 2 KOH + Cl2 → KCl + KClO + H2O
V roku 1801 odporučil William Cruickshank používať chlórovú vodu ako dezinfekčný prostriedok v nemocniciach, čo sa ukázalo byť účinným pri epidémii cholery v 1831 a Ignác Filip Semmelweis vo viedenskej a neskôr v peštianskej nemocnici nariadenou dezinfekciou rúk medikov a doktorov chlórovým vápnom takmer úplne potlačil dovtedy bežnú horúčku šestonedieľok[6].
V prvej svetovej vojne bol chlór použitý ako chemická zbraň. 22. apríla 1915 začala nemecká armáda ofenzívu pri belgickom meste Ypres, známu ako Druhá bitka o Ypres. Po intenzívnej delostreleckej príprave však boli namiesto klasického útoku pechoty použité kanistre s chlórom, ktorý sa v podobe žltozeleného mraku rozšíril v zákopoch a vo francúzskych radoch, nevybavených plynovými maskami, vyvolal paniku spojenú s ústupom z pozícií. Po tomto útoku sa chlór, resp. iné dusivé a dráždivé látky ako fosgén a yperit začali používať na oboch stranách frontu až do skončenia vojny[7].
Vlastnosti[upraviť | upraviť zdroj]

Fyzikálne vlastnosti[upraviť | upraviť zdroj]
Chlór je za normálnych podmienok plyn žltozelenej farby, tvorený dvojatómovými molekulami Cl2 viazanými kovalentnou väzbou so zdieľaným elektrónovým párom[8]. Vzdialenosť väzby Cl-Cl je 198 pm, disociačná energia 242,58 kJ/mol (dokonca vyššia ako pri fluóre, čo sa vysvetľuje odpudzovaním voľných elektrónových párov na π orbitáloch[8]). Molekulami Cl2 je tvorená aj kvapalná a tuhá fáza. Chlór kryštalizuje v rombickej sústave, tvorí vrstevnaté kryštály a je izoštruktúrny s brómom a jódom[5]. Molekuly v kryštáli sú viazané len slabými van der Waalsovými silami z toho vyplýva nízka teplota topenia, a prakticky žiadna elektrická vodivosť[3].
Molekula Cl2 je nepolárna, takže sa dobre rozpúšťa v nepolárnych rozpúšťadlách ako tetrachlórmetán, alebo chloroform. Vo vode sa rozpúšťa slabo – na 1 dm3 vody sa pri 20 °C rozpustí 2,3 dm3 chlóru, pričom s vodou reaguje podľa rovnice:
- Cl2 + 2 H2O ↔ HClO + H3O+ + Cl-
Vzniknutý roztok sa nazýva chlórová voda. Pri zavádzaní do vody s teplotou 0 °C sa vylučujú žltozelené klatrátové kryštály[2] so vzorcom Cl2·7,3H2O[4].
Chemické vlastnosti[upraviť | upraviť zdroj]
Chlór je veľmi reaktívny prvok, priamo sa zlučuje s väčšinou prvkov periodickej tabuľky. S vodíkom reaguje za vzniku chlorovodíka, reakcia je katalyzovaná svetlom. Rovnako odoberá vodík z uhľovodíkov, až napokon ostáva iba elementárny uhlík. Viaceré prvky sa v chlóre spaľujú (napr. fosfor, antimón, niektoré kovy). Reakciu medi, resp. železa iniciujú už stopové množstvá vody, v suchom stave tieto prvky s chlórom nereagujú[2].
Spôsob väzby[upraviť | upraviť zdroj]
Elektrónová konfigurácia chlóru je [Ne]3s23p5, do zaplnenia valenčnej vrstvy a teda dosiahnutia konfigurácie najbližšieho vzácneho plynu argónu mu chýba iba jeden elektrón. To predurčuje jeho chemické vlastnosti – vysokú hodnotu elektronegativity a elektrónovej afinity[5]. Elektronegativita je po fluóre a kyslíku tretia najvyššia spomedzi prvkov a afinita je dokonca vyššia ako pri fluóre (opať je príčinou silnejšie odpudzovanie pristupujúceho elektrónu do kompaktnej valenčnej vrstvy fluóru[2]). Maximálne oxidačné číslo chlóru je VII, v kladnom oxidačnom stupni sa vyskytuje len v zlúčeninách s elektronegatívnejšími prvkami, teda s fluórom a kyslíkom.
Izotopy[upraviť | upraviť zdroj]
Chlór sa v prírode nachádza v dvoch izotopoch 35Cl a 37Cl. Oba sú stabilné, pričom 75,77 % prírodného chlóru pripadá na izotop 35Cl a zvyšok, t. j. 24,23 %, izotopu 37Cl[9]. Najstabilnejším rádioaktívnym izotopom je 36Cl s polčasom rozpadu 3,01·105 roka a v laboratóriách sa používa aj 38Cl s polčasom rozpadu 37,1 min[5].
Výskyt v prírode[upraviť | upraviť zdroj]
Na Zemi sa chlór vďaka svojej reaktívnosti nachádza iba vo forme zlúčenín v oxidačnom stupni -I, väčšinou rozpustných vo vode. Celkové zastúpenie chlóru v zemskej kôre je 126 ppm, v oceánoch a moriach je koncentrácia chloridových iónov 1,9 %. Menšie množstvá chloridov, aj keď s oveľa vyššími koncentráciami, sa nachádzajú vo vnútrozemských slaných jazerách (napr. v Mŕtvom mori je koncentrácia chloridov cca 24 %)[5].
Medzi najbežnejšie minerály chlóru patria halit (kamenná soľ – NaCl), sylvín (KCl), carnallit (KMgCl3·6H2O) a kainit (MgSO4·KCl·3H2O)[10], ktoré vznikli odparením slaných vôd v minulosti Zeme a často sú sprevádzané aj inými, vo vode rozpustnými minerálmi[11]. Významné ložiská kamennej soli v Európe sa nachádzajú v Poľsku pri Bochni a Veličke, v Rumunsku pri Slaníku, v Rakúsku v Soľnej komore pri Salzburgu, v Rusku pri Astrachanských jazerách.
Na Slovensku sa kamenná soľ nachádza v Solivare pri Prešove, v Zbudzi a Zalužiciach pri Michalovciach a v obci Soľ v okrese Vranov nad Topľou[12]. Všetky slovenské ložiská sú treťohorného pôvodu[13]. V Solivare sa soľ ťažila už od 15. storočia, najskôr banským spôsobom a neskôr, keď v roku 1752 došlo k zatopeniu baní, sa ťažila už len soľanka[13]. V súčasnosti je komplex objektov na čerpanie a varenie soli (šachta Leopold, varňa, sklad soli, kováčske dielne a klopačka) národná kultúrna pamiatka a patrí medzi najvýznamnejšie technické pamiatky na Slovensku. V priestoroch varne je od roku 2001 zriadená expozícia Slovenského technického múzea pod názvom Dejiny ťažby a výroby soli v Solivare[14].
Zlúčeniny[upraviť | upraviť zdroj]
Chlorovodík[upraviť | upraviť zdroj]

Chlorovodík je bezfarebný plyn s charakteristickým zápachom a s bodom varu −85,1 °C. Je to jedna z najpoužívanejších zlúčenín chlóru tak v priemysle, ako aj v laboratóriách[5]. Priemyselne sa vyrába priamym spaľovaním vodíka s chlórom, alebo ako vedľajší produkt chlorácie uhľovodíkov. Ďalšie spôsoby prípravy (hlavne v minulosti, ale používané aj v súčasnosti) – reakciou chloridu sodného s kyselinou sírovou[5]
- NaCl + H2SO4 → NaHSO4 + HCl (150 °C)
- NaCl + NaHSO4 → Na2SO4 + HCl (540 – 600 °C)
a Hargreavesov proces – reakciou chloridu sodného so zmesou oxidu siričitého, vzduchu a vody[5]:
- 2 NaCl + SO2 + ½ O2 + H2O → Na2SO4 + 2 HCl (430 – 450 °C)
Chlorovodík sa vo vode veľmi dobre rozpúšťa, koncentrovaný roztok má obsah 40 %HCl (komerčne sa predáva ako 37% roztok) a nazýva sa kyselina chlorovodíková. Kyselina chlorovodíková je taktiež široko používaná v priemysle a v zriedenej forme sa vyskytuje aj ako súčasť žalúdočných štiav[2].
Zmes kyseliny chlorovodíkovej a dusičnej v pomere 3:1 sa nazýva lúčavka kráľovská. Táto zmes rozpúšťa aj kovy ako zlato alebo platina vďaka chloridu nitrozylu (NOCl), ktorý vzniká reakciou
- HNO3 + 3 HCl ↔ NOCl + Cl2 + 2 H2O
Chloridy[upraviť | upraviť zdroj]
Chloridy sú zlúčeniny chlóru s inými, menej elektronegatívnymi prvkami, s výnimkou vzácnych plynov. Väčšinu z nich možno považovať za soli kyseliny chlorovodíkovej. Podľa štruktúry sa delia na:
- Iónové chloridy, v ktorých prevládajú iónové väzby. Ide o chloridy alkalických kovov, kovov alkalických zemín, prvkov 3. skupiny periodickej tabuľky, lantanoidov a aktinoidov[2]. Sú to kryštalické látky rozpustné vo vode a ich vodné roztoky dobre vedú elektrický prúd. Elektrický prúd vedú aj ich taveniny[4].
- Molekulové chloridy sú kovalentné zlúčeniny tvorené individuálnymi molekulami viazanými iba slabými medzimolekulovými silami[10]. Väčšinou sú to preto plynné alebo kvapalné látky, pokiaľ sú tuhé, bývajú ľahko prchavé[2]. Patria sem chloridy prechodných prvkov vo vyššom oxidačnom stupni, ako TiCl4, SnCl4, NbCl5, chloridy nekovov a polokovov (uhlíka, bóru, arzénu, fosforu, síry a pod.).
- Chloridy s polymérnou štruktúrou sú taktiež kovalentné zlúčeniny, ale sa vrstevnantým, reťazcovým, alebo priestorovým usporiadaním. Prevažne sú to chloridy kovov v nižších oxidačných stupňoch, ako FeCl3, AlCl3, CdCl2.
Chloridy s kovalentnými väzbami vo vode často hydrolyzujú.
- BCl3 + 3 H2O → H3BO3 + 3 HCl
- TiCl4 + 2 H2O → TiO2 + 4 HCl
Taktiež pri niektorých kovoch chloridový anión vystupuje ako ligand a vytvára komplexné polychloridové ióny[4]
- SbCl5 + Cl- → [SbCl6]-
Chloridy sa pripravujú:
- priamou syntézou z prvkov
- Fe + 3 Cl2 → 2 FeCl3
- rozpúšťaním prvku v kyseline chlorovodíkovej
- Zn + 2 HCl → ZnCl2 + H2
- reakciou oxidov, alebo hydroxidov kovov sa kyselinou chlorovodíkovou
- KOH + HCl → KCl + H2O
- reakciou kyseliny chlorovodíkovej alebo rozpustného chloridu so soľou prvku, ktorej chlorid je nerozpustný
- AgNO3 + NaCl → NaNO3 + AgCl
- zahrievaním oxidov s uhlíkom v prúde chlóru
- SiO2 + 2 C + 2 Cl2 → SiCl4 + 2 CO
- zahrievaním oxidov v zmesi chloridu sírneho a chlóru (hlavne oxidy lantanoidov)
- 4 Lu2O3 + 3 S2Cl2 + 9 Cl2 → 8 LuCl3 + 6 SO2
Polychloridový anión Cl3- sa dá pripraviť zavádzaním chlóru do koncentrovaných roztokov chloridov a je oveľa menej stabilný ako známejší trijodidový anión I3-, ktorý vzniká pri rozpúšťaní jódu v roztoku jodidu draselného[10].
-
Chlorid jódny
-
Chlorid sodný
-
Chlorid sodný (halit)
-
Chlorid železnatý
-
Chlorid mangánatý
-
Chlorid platnatý
-
Chlorid chromitý
-
Chlorid železitý
Oxidy[upraviť | upraviť zdroj]
S kyslíkom tvorí chlór štyri oxidy – oxid chlórny (Cl2O), oxid chloričitý (ClO2), oxid chlórový (Cl2O6) a oxid chloristý (Cl2O7). Všetky oxidy chlóru sú reaktívne a nestále zlúčeniny, s tendenciou explodovať[10].
Oxid chlórny je žltočervený plyn, dobre rozpustný vo vode. Má silne oxidačné účinky a pri zahriatí exploduje. Pripravuje sa reakciou chlóru s oxidom ortutnatým podľa rovnice:
- HgO + 2 Cl2 → Cl2O + HgCl2
Oxid chloričitý je za štandardných podmienok taktiež plyn žltozelenej farby (v kvapalnom stave má červenohnedú farbu). Dobre sa rozpúšťa vo vode, roztok sa pôsobením svetla postupne rozkladá na kyselinu chlorovodíkovú a chlorečnú. Oxid chloričitý je silné oxidačné činidlo, využíva sa pri bielení buničiny a komerčne sa pripravuje reakciou chlorečnanu sodného, oxidu siričitého a kyseliny sírovej[10].
Oxid chlórový sa dá pripraviť ozonizáciou oxidu chloričitého. Je to veľmi nestála kvapalina červenej farby, ktorá reaguje explozívne pri styku s organickými látkami, alebo redukčnými činidlami. Oxid chloristý je najstabilnejším oxidom chlóru, napriek tomu však pri náraze môže explodovať. Je to kvapalná látka, s vodou alebo roztokmi hydroxidov reaguje za vzniku kyseliny chloristej, čiže sa považuje za jej anhydrid. Rovnako sa aj pripravuje: dehydratáciou kyseliny chloristej oxidom fosforečným[10]:
- 4 HClO4 + P4O10 → 2 Cl2O7 + 4 HPO3
Kyslíkaté kyseliny chlóru a ich soli[upraviť | upraviť zdroj]
Kyslíkaté kyseliny chlór vytvára taktiež štyri: kyselinu chlórnu (HClO), chloritú (HClO2), chlorečnú (HClO3) a chloristú (HClO4). Všetky kyslíkaté kyseliny existujú iba vo vodnom roztoku a ich sila vzrastá so zvyšujúcim sa oxidačným číslom chlóru, t. j. najslabšia je kyselina chlórna a najsilnejšia kyselina chloristá. Kyseliny, rovnako ako aj ich soli majú oxidačné účinky[10].
Kyselina chlórna sa dá pripraviť zavádzaním plynného chlóru do vody, keď dochádza k disproporcionácii:
- Cl2 + 2 H2O ↔ HClO + H3O+ + Cl-
prípadne reakciou chlóru so suspenziou oxidu ortutnatého. Soli kyseliny chlórnej sú chlórnany, dajú sa pripraviť reakciou chlóru s roztokmi hydorxidov, alebo anodickou oxidáciou chloridového iónu pri elektrolýze roztokov chloridov. Komerčne používaný a predávaný je roztok chlórnanu sodného NaClO, ktorý sa používa na dezinfekciu (aj vody). Kyselina chloritá taktiež existuje iba v roztoku, dá sa pripraviť napr. zrážacou reakciou chloritanu bárnatého s kyselinou sírovou a následnom odfiltrovaní vyzrážaného síranu bárnatého. Nemá praktický význam, ale jej soli sa používajú ako bieliace činidlá. Získavajú sa reakciou oxidu chloričitého s roztokmi zásad:
- 2 ClO2 + 2 OH- → ClO2- + ClO3- + H2O
Chloritany vznikajú aj disproporcionáciou chlórnanov v kyslom prostredí, reakcia je posunutá doprava vplyvom teploty – pri izbovej teplote k rozkladu chlórnanu prakticky nedochádza.
Kyselina chlorečná je je nestála kvapalina so silno oxidačnými účinkami. Zo solí sú najznámejšie chlorečnan sodný a draselný. Sodná soľ je základnou zložkou herbicídu Travex. Okrem toho sa chlorečnany vyznačujú veľmi silnými oxidačnými vlastnosťami a bývajú zložkami pyrotechnických zmesí (bengálske ohne). Kyselina chloristá HClO4 je jednou z najsilnejších kyselín. Vyrába sa zvyčajne termickou disproporcionáciou chlorečnanov na chloristany a následnou destiláciou po okyslení. Komerčne sa distribuuje ako vodný roztok s približne 70% koncentráciou, ktorý je prakticky neobmedzene stály. V zriedených roztokoch sa kyselina chloristá správa iba ako veľmi silná kyselina. V koncentrovanom stave a za tepla je však mimoriadne silným oxidačným prostriedkom.
Väčšina solí kyseliny chloristej, chloristanov, sú zlúčeniny veľmi dobre rozpustné vo vode. Výnimku tvoria chloristan draselný KClO4, rubídny RbClO4, cézny CsClO4 a amónny NH4ClO4[10]. V analytickej chémii slúži tento jav na dôkaz alebo separáciu spomenutých katiónov. Chloristan draselný a amónny sú zložky rôznych pyrotechnických zmesí a chloristan amónny je základom pevného paliva raketových motorov, využívajú ich napr. aj americké raketoplány.
-
Oxid chloričitý
-
Chloritan sodný
-
Chlorečnan draselný
-
Chlorečnan sodný
-
Kyselina chloristá
-
Hexahydrát chloristanu kobaltnatého
-
Hexahydrát chloristanu meďnatého
-
Chloristan draselný
Interhalogénové zlúčeniny[upraviť | upraviť zdroj]
V zlúčeninách s fluórom vystupuje chlór v kladnom oxidačnom stupni, sú známe fluoridy chlórny, chloritý a chlorečný. Sú to veľmi reaktívne látky, ochotne sa zlučujúce s mnohými prvkami a zlúčeninami, v prípade organických molekúl často reagujú explozívne[15]. Využívajú sa ako fluoračné činidlá, fluorid chloritý aj pri spracovaní nukleárneho paliva, ako oxidačný agent uránu na fluorid uránový, ktorý sa následne používa na obohatenie uránu o izotop 235U[5].
Fluorid chloritý sa pripravuje priamou reakciou daných prvkov pri teplote 200 – 300 °C. Pri nadbytku chlóru sa dá reakciou pripraviť fluorid chlórny a pri nadbytku fluóru naopak fluorid chlorečný[10]. Fluorid chlórny je tepelne stály bezfarebný plyn, reaguje s väčšinou kovov aj nekovov už pri izbovej teplote za uvoľnenia chlóru a vzniku fluoridu príslušného prvku[5]. Florid chloritý je bezfarebná prchavá kvapalina, ktorá reaguje aj s materiálmi, všeobecne považovanými za inertné, ako azbest, betón a piesok. Rovnako za zvýšenej teploty reaguje aj s prvkami ako xenón a radón a nereaktívnymi kovmi ako paládium, platina a zlato[5]. Transportuje sa v nádobách z niklu, nakoľko jeho povrch sa pokrýva kompaktnou vrstvou fluoridu nikelnatého, ktorá zabraňuje ďalšej oxidácii.
Organické zlúčeniny chlóru[upraviť | upraviť zdroj]
| Vodík | Energia väzby |
|---|---|
| R-CH3 | 420 kJ/mol |
| R2-CH2 | 401 kJ/mol |
| R3-CH | 390 kJ/mol |
Chlórderiváty, t. j. organické zlúčeniny s jedným, alebo viacerými atómami chlóru viazanými na uhlík/y organickej zlúčeniny predstavujú širokú škálu organických zlúčenín, používaných ako rozpúšťadlá, anestetiká, pesticídy, atď. Väzba C–Cl je v dôsledku rozdielu elektonegativít polárna s čiastkovým kladným nábojom na uhlíku a záporným na chlóre. Čo má za následok, že uhlík, na ktorý je chlór naviazaný, sa správa pri reakciách ako elektrofilná častica[16].
Chlórderiváty sa pripravujú:
- Priamou reakciou uhľovodíka s chlórom. Reakcia je iniciovaná UV žiarením, nevýhodou je zlá kontrola priebehu reakcie a široká paleta produktov. Pre vyššie uhľovodíky (počnúc propánom) sa dá pozorovať rozdiel v pravdepodobnosti substitúcie na primárnom (R-CH3), sekundárnom (R2-CH2) alebo terciálnom vodíku (R3-CH). Najmenej reaktívne sú primárne vodíky, najviac terciálne. Príčinou je rozdielna energia väzby C-H[16].
- Adíciou chlóru, prípadne chlorovodíka na násobnú väzbu. V prípade adície chlorovodíka na nesymetrický alkén (napr. propén) sa chlór viaže podľa Markovnikovovho pravidla na ten uhlík, kde je menej vodíkov[16].
- Haloformová reakcia – reakcia ketónov obsahujúcich metylovú skupinu s chlórom (všeobecne s halogénom) za prítomnosti zásady (hydroxid sodný)[17]. Touto reakciou sa v minulosti priemyselne vyrábal chloroform.
- Reakciou alkoholov s chlorovodíkom za prítomnosti chloridu zinočnatého.
- Reakciou s inými chloračnými činidlami, ako SOCl2, PCl5, PCl3[16].
Chlórderiváty reagujú s nukleofilnými činidlami, napr s alkoholátmi za vzniku éterov. Wurtzovou syntézou z dvoch chlóralkánov za prítmonosti kovového sodíka vzniká alkán s počom uhlíkov rovnajúcim sa súčtu uhlíkov reagentov (dôjde k spojeniu reťazcov)[18]. Obdobná reakcia pre aromatizované chlórderiváty je Wurtz-Fittigova reakcia. Dôležité sú aj grignardove činidlá (R–MgX, kde X je halogén), slúžiace prípravu sekudárnych, resp. terciálnych alkoholov z ketónov[19].
Viaceré organické zlúčeniny chlóru majú toxické účinky na rastliny, živočíchy aj na človeka. Napr. DDT, masívne používaný insekticíd v 50. rokoch 20. storočia sa akumuluje v potravinovom reťazci a narúša funkciu androgénnych hormónov. V potravinovom reťazci sa rovnako kumulujú aj dioxíny, skupina polychlórovaných dibenzo-p-dioxínov a dibenzofuránov, ktorá vzniká ako produkt nedokonalého spaľovania aromatických chlórderivátov a má silné mutagénne účinky. Rozpad väzby C-Cl vo vrchných vrstvách atmosféry, vedúci k vzniku voľných Cl radikálov, viedol k zákazu používania chlór-fluorovaných uhľovodíkov, známych pod komerčným názvom freóny, nakoľko radikály Cl následne reagujú s ozónom a narúšajú ozónovú vrstvu[5].
-
trichlórmetán (chloroform)
-
tetrachlórmetán (chorid uhličitý)
-
dichlórdifluórmetán (freón R12)
-
chlóretén (vinylchlorid)
-
Kyselina trichlóroctová
-
Polychlórované bifenyly (PBC)
-
dichlórdifenyltrichlóretán (DDT)
-
2,2-dichlór-N-[(aR,bR)-b-hydroxy-a-hydroxymetyl-4-nitrofenetyl]acetamid (chloramfenikol)
Výroba[upraviť | upraviť zdroj]
Priemyselne sa chlór získava elektrolýzou vodného roztoku chloridu sodného, tzv. soľanky[20], prípadne elektrolýzou chloridu draselného. Ako vedľajšie produkty elektrolýzy vznikajú vodík a hydroxid sodný, resp. draselný. Elektrochemické deje sa dajú popísať rovnicami:
Všetky produkty sú vysoko reaktívne, preto je potrebné ich oddeliť, aby nedochádzalo k spätnej reakcii chlóru s vodíkom, resp. s hydroxidom. Najstarší spôsob, používaný od konca 19. storočia je amalgámový (nazývaný aj Castnerov–Kellnerov proces), kde sa ako anóda používa grafit (prípadne titán, alebo iný nereaktívny prvok) a katóda je ortuťová. Sodné, resp. draselné katióny, ktoré zostávajú v roztoku po anodickej oxidácii chloridových iónov reagujú s ortuťou za vzniku amalgámu. Ten kontinuálne odteká do druhej nádoby, kde reakciou s vodou vzniká príslušný hydroxid a vodík a recyklovaná ortuť sa vracia späť do elektrolyzéra. V súčasnosti sa od tohto spôsobu upúšťa, vzhľadom toxicitu ortuti, ako aj na vyššiu energetickú náročnosť oproti diafragmovej, resp. membránovej elektrolýze[21].
Membránová elektrolýza je v súčasnosti najpoužívanejší spôsob priemyselnej výroby chlóru. V elektrolyzéri je roztok soľanky rozdelený membránou, ktorá je polopriepustná, t. j. umožní prestup Na+ do pravej časti, ale zabráni prestupu OH- do ľavej. Výhodou tohto procesu je nižšia energetická náročnosť oproti klasickej ortuťovej elektrolýze, nevýhodou vyššie požiadavky na čistotu vstupujúcej soľanky[5][22].

Proces diafragmovej elektrolýzy soľanky je dosť podobný membránovej, ako oddeľovač anódového a katódového priestoru sa používa diafragma za azbestu, prípadne polymérnych vlákien. Soľanka vstupuje na strane anódy, kde dochádza k oxidáciu Cl-, sodíkové ióny prechádzajú diafragmou na stranu katódy. Výhodou je opäť nižšia spotreba elektrickej energie, nevýhodou nižšia koncentrácia roztoku hydroxidu a potreba dodatočného zahusťovania produktov[23].
Laboratórne sa chlór vyrába oxidáciou vodných roztokov bežných chloridov (najčastejšie chlorid sodný) silnými oxidačnými činidlami (napr. oxid manganičitý) v kyslom prostredí:
- 4 NaCl + 2 H2SO4 + MnO2 → 2 Na2SO4 + MnCl2 + 2 H2O + Cl2
Použitie[upraviť | upraviť zdroj]
Chlórované organické rozpúšťadlá[upraviť | upraviť zdroj]
Najjednoduchšie významné chlórované uhľovodíky sú trichlórmetán alebo chloroform CHCl3 a tetrachlórmetán, nazývaný „tetrachlór“ CCl4. Obidve zlúčeniny sú ťažké kvapaliny s relatívne nízkym bodom varu (CHCl3 62 °C a CCl4 77 °C). Obidve sú nehorľavé a pri vdychovaní sú toxické (narkotizujú; CCl4 je silne hepatotoxický, oba sú karcinogény). Chloroform má navyše narkotizačné účinky a bol v 19. a prvej polovici 20. storočia široko používaný v medicíne ako inhalačné anestetikum pri operáciach, pôrodoch a podobných zákrokoch.
- Obidve kvapaliny sa prakticky nemiešajú s vodou, ale sú výbornými rozpúšťadlami nepolárnych organických zlúčenín a tukov. Ešte pred niekoľkými rokmi prakticky všetky čistiarne odevov prali tovar svojich zákazníkov v zmesi týchto kvapalín. Organické znečistenie bolo veľmi efektívne odstránené a vďaka nízkemu bodu varu čistiacej zmesi boli ich zostatky z odevov zahriatím ľahko odstrániteľné.
- Mnoho farieb na kovy aj drevo používalo ako rozpúšťadlo pigmentov a ochranných látok práve chloroform či tetrachlór.
- Vďaka nehorľavosti tetrachlórmetánu slúžil tento ako náplň niektorých hasiacich prístrojov.
- Obidve látky sa dodnes obmedzene používajú na extrakciu tukov z biologického materiálu a na separáciu organických zlúčenín zo zmesí typu kvapalina-kvapalina.
- Podrobné dlhodobé klinické štúdie však bohužiaľ ukázali, že trvalý dlhodobý styk organizmu s týmito rozpúšťadlami značne zvyšuje riziko vzniku rakoviny a obidve zlúčeniny sa tak dostali do zoznamu karcinogénnych látok. Na základe týchto skutočností je v súčasnosti veľmi obmedzená ako produkcia tak aj praktické využitie týchto organických rozpúšťadiel.
PCB[upraviť | upraviť zdroj]

Podobný osud má aj skupina organických chlórovaných aromatických uhľovodíkov nazvaná polychlórované bifenyly alebo PCB. Existuje celkom 208 kongenerov, ktoré sa líšia počtom atómov chlóru a ich vzájomnou polohou na bifenylovom skelete. Majú vyšší bod varu, sú nehorľavé a chemicky mimoriadne stále kvapaliny. Sú to výborné rozpúšťadlá nepolárnych organických zlúčenín a tukov.
- Hlavné uplatnenie našli PCB ako náplne transformátorov, kondenzátorov a ďalších elektrických zariadení.
- Používali sa ešte ako hydraulické kvapaliny, časti tlačových farieb, náterových hmôt, tmelov a ďalších výrobkov.
- PCB boli v dobe ich výroby považované za úplne neškodné látky a na ich únik do prostredia nebol braný ohľad. Až po desaťročiach ich používania bolo zistené, že PCB sa v prírode nerozkladajú, koncentrujú sa v telách živočíchov a šíria sa v potravinových reťazcoch a že majú aj v stopových množstvách nepriaznivé účinky na živé organizmy. V priebehu rokov bola ich výroba zastavená a ich používanie zakázané.
- Pri likvidácii odpadov s obsahom PCB spaľovanie prebieha pri teplote nad 1 200 °C s dobou zdržania spalín v dopaľovacej komore 2 až 3 sek. a obsahom kyslíka min. 6 %.
DDT[upraviť | upraviť zdroj]
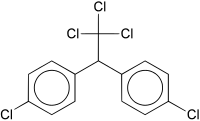
DDT je skratka zlúčeniny dichlordifenyltrichlóretán alebo 1,1,1-trichloro-2,2-bis(p-chlorofenyl)etán (ClC6H4)2CH(CCl3), jeden z najstarších a najznámejších insekticídov.
DDT bolo prvýkrát syntetizované už v roku 1874. Jeho insekticídne účinky však objavil až švajčiarsky chemik Paul Hermann Müller v roku 1939. Od druhej svetovej vojny bolo DDT hromadne používané. Slúžilo ako prípravok proti škodlivému hmyzu v poľnohospodárstve, ale predovšetkým na likvidáciu komárov a moskytov v tropických krajinách.
PVC[upraviť | upraviť zdroj]

Polymér polyvinylchlorid alebo PVC patrí dodnes k najrozšírenejším priemyselne vyrábaným plastickým hmotám. Vyrába sa polymeráciou nenasýteného chlórovaného uhľovodíka vinylchloridu. Vzniknutý produkt sa ďalej farbí a plní rôznymi aditívami, takže na trh sa dostáva veľmi široká paleta plastov s rozdielnymi farbami a fyzikálnymi vlastnosťami.
- Všetky vyrábané druhy PVC sa vyznačujú dobrou chemickou odolnosťou, sú veľmi zle horľavé a tepelne dobre odolné. Povrch plastu je veľmi ľahko umývateľný vodou. Z týchto dôvodov sa používajú k výrobe podlahových krytín a bytových textílií. Povrchy domácich záhradných bazénov sú často pokryté vrstvou PVC, z PVC sa vyrábajú armatúry pre rozvody pitných aj odpadových vôd.
- Ďalšie využitie nachádza PVC v medicíne ako inertná súčasť rôznych prístrojov (hadičky, trubičky, zásobníky tekutín…), ale sú z neho napr. vyrábané aj hračky pre deti.
- Problém s PVC nastáva v okamihu jeho horenia alebo tepelného rozkladu. Napriek tomu že je za normálnych okolností takmer nehorľavý, za vysokých teplôt (napr. pri požiari bytu) začína tepelne degradovať pričom sa uvoľňuje široké spektrum veľmi toxických organických zlúčenín (najznámejší je asi fosgén). Aj pri riadenom spaľovaní sa do plynných splodín dostávajú atómy chlóru, ktoré pôsobia silne korozívne na spaľovacie aparatúry vďaka vznikajúcemu chlorovodíku. Reakciou chlóru s aromatickými uhľovodíkmi dochádza ku vzniku zvlášť nebezpečných dioxínov.
Dioxíny[upraviť | upraviť zdroj]


Dioxíny predstavujú ekologicky najproblematickejšie organické zlúčeniny chlóru. Týmto názvom sú označované dve skupiny látok: Polychlórované dibenzo-p-dioxíny a dibenzofurany. Výmenou jedného alebo niekoľkých vodíkových atómov za atómy chlóru vznikajú zlúčeniny, ktoré sú zvyčajne označované súhrnným názvom dioxíny. Tieto látky sa vyznačujú značnou priamou toxicitou, sú však aj silno mutagénne a karcinogénne.
Tieto zlúčeniny sa priemyselne nevyrábajú, vznikajú skôr ako nechcené prímesi pri chemickej syntéze iných aromatických chlórovaných látok. Často uvádzaným príkladom je Agent Orange, ktorý bol vo Vietnamskej vojne hromadne rozprašovaný americkou armádou na tropické pralesy s cieľom zbaviť porasty listov. Napriek tomu, že dioxíny pôvodne neboli zložkou tejto zmesi, vyskytovali sa v nej v relatívne značnom množstve vďaka nedokonalému čisteniu základných zložiek. Dodnes sú vo Vietname oblasti, kde je pôda tak zaťažená týmito látkami, že ju nie je možné poľnohospodársky využívať. Ďaleko tragickejšie sú však tisíce prípadov mŕtvo narodených detí, detí narodených s hroznými deformáciami a extrémny nárast prípadov rakoviny v postihnutých oblastiach. Problémy sa nevyhli ani americkým vojakom a veľa veteránov Vietnamskej vojny malo podobné syndrómy ako vietnamskí domorodci. To všetko sa dáva do súvislosti s dlhodobým kontaktom postihnutých osôb s dioxínmi obsiahnutými v Agent Orange.

Rozhodne najvýznamnejším zdrojom dioxínov v životnom prostredí je spaľovanie organických zlúčenín, predovšetkým komunálneho odpadu. Dôvodom je najmä fakt, že aromatické benzénové jadro je veľmi stále a pri spaľovaní organických zlúčenín dochádza k prednostnej oxidácii bežných uhľovodíkov. Benzénový skelet pritom často zostáva nedotknutý a jeho reakciou s kyslíkom a chlórom vznikajú dioxíny.
- V súčasnosti sú spaľovne komunálneho odpadu konštruované tak, aby sa zničila prevažná väčšina vznikajúcich dioxínov. Dosahuje sa to tak, že spaliny z primárneho spaľovania odpadu vstupujú do druhého spaľovacieho stupňa, v ktorom je zvyčajne zvýšená teplota na viac ako 1 500 °C. Kombináciou vysokej teploty spaľovania a predĺženého pobytu organických zlúčenín v tomto prostredí je možné dosiahnuť prakticky kompletnú oxidáciu prítomných dioxínov. Niektoré spaľovne sú vybavené ešte aj tretím spaľovacím stupňom. Všetky spaľovne sú navyše zo zákona pravidelne kontrolované a obsah dioxínov v splodinách je monitorovaný.
- Bolo dokázané, že vplyv jednotlivých kongenerov dioxínov na živé organizmy sa podstatne odlišuje. Pre zjednodušenie bol vybraný jeden z nich – 2,3,7,8-tetrachlorodibenzen-p-dioxín (obrázok) a pri uvádzaní koncentrácie dioxínov v analytickej vzorke sa zvyčajne obsahy všetkých prítomných dioxínov vzťahujú na túto zlúčeninu.
Referencie[upraviť | upraviť zdroj]
- ↑ HOUSECROFT, Catherine. Inorganic Chemistry. 2. vyd. Edinburgh : Pearson Education, 2005. 949 s. ISBN 0130-39913-2. Kapitola The group 17 elements, s. 468 – 491. (po anglicky)
- ↑ a b c d e f g GAŽO, Ján a kol.. Všeobecná a anorganická chémia. 3. vyd. Bratislava : ALFA SNTL, 1981. 808 s. Kapitola Halové prvky, s. 278 – 305.
- ↑ a b MUCK, Alexander. Základy struktúrní anorganické chemie. 1. vyd. Praha : Academia, 2006. 508 s. ISBN 80-200-1326-1. Kapitola Halogeny, s. 159 – 181. (po česky)
- ↑ a b c d Encyclopedia of Inorganic Chemistry, 10 volume set, 2nd Edition. Ed. Bruce R. King. 2. vyd. [s.l.] : Wiley, 2005-september. 10 zv. (6696 s.) ISBN 978-0-470-86078-6. Kapitola Chlorine, Bromine, Iodine, & Astatine: Inorganic Chemistry. (po anglicky)
- ↑ a b c d e f g h i j k l m n o p q GREENWOOD. Chemistry of the Elements. 2. vyd. Oxford : Butterworth-Heinemann, 1997. 1341 s. ISBN 0-7506-3365-4. Kapitola The Halogens: Fluorine, Chlorine, Bromine, Iodine and Astatine, s. 789 – 887. (po anglicky)
- ↑ Ignác Semmelweis – priekopník čistých rúk a blázon [online]. 2014-05-29, [cit. 2018-08-18]. Dostupné online. Archivované 2018-06-14 z originálu.
- ↑ SINNOTT, John P.. Weaponry: Use of Chlorine Gas Cylinders in World War I [online]. [Cit. 2018-08-20]. Dostupné online. (po anglicky)
- ↑ a b Encyclopedia of Physical Science an Technology. Ed. Robert A. Meyers. 3. vyd. [s.l.] : Elsevier, 2001. 18 zv. (15453 s.) ISBN 978-0-12-227410-7. Kapitola Halogen chemistry. (po anglicky)
- ↑ CHOPPIN, Gregory; LILJENZIN, Jan-Olov; RYDBERG, Jan; EKBERG, Christian. Radiochemistry and Nuclear Chemistry. 4. vyd. [s.l.] : Elsevier, 2013. 858 s. ISBN 978-0-12-405897-2. Kapitola Nuclei, Isotopes and Isotope Separation. (po anglicky)
- ↑ a b c d e f g h i COTTON, Albert; WILKINSON, Geofrey. Advanced Inorganic Chemistry. 3. vyd. [s.l.] : Wiley, 1972. 1143 s. ISBN 0-471-17560-9. Kapitola The Group VII Elements F, Cl, Br, I, At, s. 458 – 494. (po anglicky)
- ↑ PETRÁNEK, Jan. Geologická encyklopedie [online]. [Cit. 2018-08-19]. Dostupné online. (po česky)
- ↑ Minerály a horniny Slovenska [online]. [Cit. 2018-08-19]. Dostupné online. Archivované 2018-11-26 z originálu.
- ↑ a b KODĚRA, Miroslav. Topografická mineralógia Slovenska. 1. vyd. Bratislava : VEDA, 1990. 1590 s. ISBN 80-224-0193-5.
- ↑ Solivar v Prešove [online]. [Cit. 2018-08-19]. Dostupné online.
- ↑ SHRIVER, Duward; PETER, Atkins. Shriver and Atkins' Inorganic Chemistry. 5. vyd. [s.l.] : W. H. Freeman, 2009. 830 s. ISBN 978-1-42-921820-7. Kapitola The Group 17 Elements, s. 419 – 439. (angličtina)
- ↑ a b c d MCMURRY, John. Organic chemistry. 7. vyd. [s.l.] : Thomson Brooks/Cole, 2008. 1318 s. ISBN 978-0-495-11628-8. Kapitola Organohalides. (po anglicky)
- ↑ Haloform Reaction [online]. [Cit. 2018-09-23]. Dostupné online.
- ↑ Wurtz Reaction [online]. [Cit. 2018-09-23]. Dostupné online.
- ↑ Grignard Reaction [online]. [Cit. 2018-09-23]. Dostupné online.
- ↑ EURO CHLOR. How are chlorine and caustic soda made? [online]. [Cit. 2019-10-03]. Dostupné online. (angličtina)
- ↑ EURO CHLOR. Mercury cell process [online]. [Cit. 2019-10-03]. Dostupné online. (angličtina)
- ↑ EURO CHLOR. Membrane cell process [online]. [Cit. 2019-10-03]. Dostupné online. (angličtina)
- ↑ EURO CHLOR. Diaphragm cell process [online]. [Cit. 2019-10-03]. Dostupné online. (angličtina)
Iné projekty[upraviť | upraviť zdroj]
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| Alkalické kovy | Kovy alk. zemín | Lantanoidy | Aktinoidy | Prechodné prvky | Kovy | Polokovy | Nekovy | Halogény | Vzácne plyny |
























![2,2-dichlór-N-[(aR,bR)-b-hydroxy-a-hydroxymetyl-4-nitrofenetyl]acetamid (chloramfenikol)](http://upload.wikimedia.org/wikipedia/commons/thumb/6/6c/Sample_of_Chloramphenicol.jpg/88px-Sample_of_Chloramphenicol.jpg)